| Natureduca - Portal educativo de ciencia y cultura |

Química
ESPECTROS, ÁTOMOS Y NÚCLEOS
Espectros y estructura atómica - 6ª parte
Determinación de la energía del electrón en el modelo de Bohr
 a determinación de los niveles de
energía En del electrón en el modelo de Bohr se
efectúa combinando un análisis típico de la mecánica clásica con la condición de
cuantificación expresada en el cuarto postulado.
a determinación de los niveles de
energía En del electrón en el modelo de Bohr se
efectúa combinando un análisis típico de la mecánica clásica con la condición de
cuantificación expresada en el cuarto postulado.


(16.8)


La energía total, suma de cinética y potencial, será, por tanto:

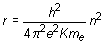
(16.10)

Aplicación de las ecuaciones características del modelo de Bohr
Determinar el valor de la longitud de onda correspondiente a la onda de materia asociada al electrón de un átomo de hidrógeno: a) cuando se mueve en la órbita correspondiente al estado fundamental; b) cuando lo hace en una órbita definida por el número cuántico n = 3.a) El estado fundamental de un electrón es el estado de más baja energía. Dado que en el modelo de Bohr la energía varía con el número cuántico n según la ecuación








