| Natureduca - Portal educativo de ciencia y cultura |

Química
ESPECTROS, ÁTOMOS Y NÚCLEOS
Espectros y estructura atómica - 4ª parte
Órbitas, niveles de energía y espectros
 l modelo de Bohr fue desarrollado esencialmente para el átomo
más sencillo, el de hidrógeno, que consta de un protón y un solo electrón. Sobre
la base de sus postulados es posible determinar el radio de las órbitas
permitidas, deducir la expresión de la energía que posee el electrón en ellas y
explicar la fórmula de Rydberg de los espectros de líneas.
l modelo de Bohr fue desarrollado esencialmente para el átomo
más sencillo, el de hidrógeno, que consta de un protón y un solo electrón. Sobre
la base de sus postulados es posible determinar el radio de las órbitas
permitidas, deducir la expresión de la energía que posee el electrón en ellas y
explicar la fórmula de Rydberg de los espectros de líneas.
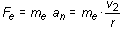
(16.6)
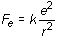
(16.7)
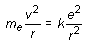
(16.8)
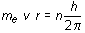
(16.9)
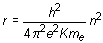
(16.10)
r = ao n2
(16.11)
La anterior ecuación indica claramente que el radio de las órbitas electrónicas en el átomo de Bohr está cuantizado, variando a saltos según la proporción 1, 4, 9, 16, 25, etc. La constante ao corresponde al radio de la primera órbita de Bohr (para n = 1 r = ao) y su cálculo a partir de las otras diferentes constantes conocidas da un resultado de 5,29 · 10-11 m.
Siguiendo razonamientos semejantes, es posible determinar la energía asociada a cada órbita que resulta ser:
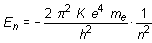
(16.12)
La energía del electrón varía de una forma discontinua. Cada valor En define un nivel o estado energético del electrón. El nivel E1, correspondiente al primer valor del número cuántico n, recibe el nombre de nivel o estado fundamental y los sucesivos E2, E3... se denominan estados excitados. El nivel fundamental corresponde al estado de mínima energía. A medida que crece n, decrece su valor absoluto En, pero debido a su carácter negativo, su valor real aumenta, de ahí que los estados excitados correspondan a niveles energéticos superiores.



