| Natureduca - Portal educativo de ciencia y cultura |

Química
ESPECTROS, ÁTOMOS Y NÚCLEOS
Espectros y estructura atómica - 1ª parte
La estructura interna del átomo
 a idea de átomo fue introducida por los filósofos de la
antigua Grecia (en griego a = no, tomo = división; es decir, sin
división) como partícula a la que se llega por sucesivas divisiones de la
materia, pero que es en sí misma indivisible.
a idea de átomo fue introducida por los filósofos de la
antigua Grecia (en griego a = no, tomo = división; es decir, sin
división) como partícula a la que se llega por sucesivas divisiones de la
materia, pero que es en sí misma indivisible.
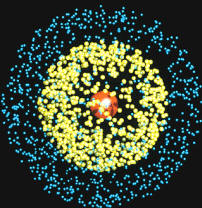
El átomo es la parte más
pequeña de un elemento, que conserva sus propiedades. Una cantidad
pequeñísima de materia contiene millones de átomos. En la ilustración se
muestra una recreación por ordenador de la estructura electrónica de un
átomo de litio.
Sin embargo, los diferentes acontecimientos de la física de finales de siglo vinieron a señalar la existencia de partículas aún más pequeñas que los átomos. En 1885 Henry Becquerel (1852-1908) observó, de un modo fortuito, que unos minerales de uranio emitían radiaciones que eran capaces de impresionar las placas fotográficas y de electrizar el aire convirtiéndolo en conductor. Esta propiedad observada inicialmente para las sales de uranio y de torio recibió el nombre de radiactividad. Este fue uno de los indicios del carácter complejo de los átomos.
Los experimentos de Crookes sobre descargas eléctricas a altas tensiones en tubos conteniendo gases a una presión reducida habían puesto de manifiesto la existencia de unos rayos que salían del cátodo o polo negativo del tubo y se dirigían al ánodo o polo positivo, como si se tratara de partículas cargadas negativamente. Además, estos rayos catódicos eran desviados por el campo magnético de un imán tal y como había sido observado con anterioridad para las corrientes eléctricas en las experiencias de electromagnetismo.Para resolver algunas controversias surgidas en relación con la naturaleza de los rayos catódicos, J. J. Thomson recibió el encargo de analizar con detalle las características de esta nueva radiación. Estudiando cuidadosamente las desviaciones que experimentaban los rayos catódicos al ser sometidos a campos eléctricos y a campos magnéticos, no sólo demostró claramente que se trataba de chorros de partículas negativas, sino que, además, midió la relación entre su carga y su masa.
Los experimentos y razonamientos de Thomson le permitieron concluir que la masa de cada una de esas partículas eran tan sólo una pequeñísima fracción de la del átomo más sencillo, el del hidrógeno. Así surgió el concepto de electrón como partícula subatómica cargada negativamente y constitutiva de los rayos catódicos, y junto con él la idea de que el átomo es divisible y, por tanto, ha de tener una estructura interna.El propio Thomson fue el primero en proponer un modelo que describiera cómo estaban constituidos internamente los átomos. Según el modelo de Thomson el átomo consistía en una esfera uniforme de materia cargada positivamente en la que se hallaban incrustados los electrones de un modo parecido a como lo están las semillas en una sandía.
Este sencillo modelo explicaba el hecho de que la materia fuese eléctricamente neutra, pues en los átomos de Thomson la carga positiva era neutralizada por la negativa. Además, los electrones podrían ser arrancados de la esfera si la energía en juego era suficientemente importante como sucedía en los tubos de descarga. Sin embargo, no fue capaz de explicar el origen de los espectros atómicos y sus características.



