| Natureduca - Portal educativo de ciencia y cultura |

Química
ESPECTROS, ÁTOMOS Y NÚCLEOS
Espectros atómicos - 2ª parte
Espectros de emisión (continuación)
Aplicación de la fórmula de Rydbreg
 abiendo que la raya Hb de la serie de Balmer del espectro del hidrógeno
corresponde a una transición entre el nivel n2 = 4 y n1 = 2, a) calcular la
longitud de onda, la frecuencia y el número de ondas correspondientes. b)
Determinar, a partir de los resultados anteriores, en qué zona del espectro
visible aparecerá dicha línea.
abiendo que la raya Hb de la serie de Balmer del espectro del hidrógeno
corresponde a una transición entre el nivel n2 = 4 y n1 = 2, a) calcular la
longitud de onda, la frecuencia y el número de ondas correspondientes. b)
Determinar, a partir de los resultados anteriores, en qué zona del espectro
visible aparecerá dicha línea.
a) De acuerdo con la fórmula de Rydberg:
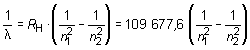
En este caso la línea H corresponde a la transición (n2 = 4) (n1 = 2), por lo
que sustituyendo en la anterior ecuación resulta, para el número de ondas
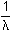 :
:
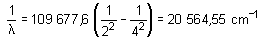
Para la longitud de onda
 :
:
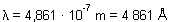
Para la frecuencia f:
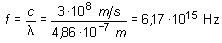
b) El espectro visible está comprendido entre 4.000 y 7.000 Å, siendo la
menor longitud de onda correspondiente al violeta y la mayor al rojo. Dado que
el espectro completo consta de siete colores (rojo, amarillo, anaranjado, verde,
azul, añil y violeta) que varían de uno a otro de una forma continua, cada color
corresponderá aproximadamente a una variación en
 de
de

Por tanto, la línea de 4.861 Å estará situada en la zona azul.
Espectros de absorción
Los espectros de emisión se caracterizan por una serie de líneas brillantes; los de absorción, por el contrario, están formados por una secuencia de líneas oscuras que aparecen sobre el fondo luminoso del espectro visible. Se producen cuando un haz de luz blanca se hace pasar por una muestra gaseosa. Si se analiza mediante un espectroscopio el haz de luz que emerge de la muestra, se observará ese conjunto de líneas oscuras que constituyen el espectro de absorción de la sustancia considerada. La luz blanca contiene una gama continua de longitudes de onda, pero sólo unas componentes definidas son sustraídas o absorbidas por los átomos que constituyen la muestra gaseosa empleada.
Todas las líneas del espectro de absorción de una muestra dada ocupan posiciones que se corresponden con algunas de las líneas del espectro de emisión de esa misma muestra. Como sucede con los espectros de emisión, los de absorción son también característicos de cada elemento químico; su análisis permite, por tanto, la identificación del elemento que en forma gaseosa se interpuso entre la fuente de luz blanca y el espectroscopio.

Espectro de emisión y
absorción. La comparación entre ambos espectros de vapores de sodio pone de
manifiesto que todas las líneas oscuras del espectro de absorción están
presentes en la forma de líneas brillantes en el espectro de emisión.
El físico alemán Fraunhofer fue el primero en detectar un espectro de absorción. Analizando la luz solar observó la presencia de más de setecientas líneas oscuras distribuidas a lo largo del espectro visible. Del análisis de este espectro pudo identificarse un grupo de líneas que no correspondía a ningún elemento conocido, deduciéndose así la existencia en la atmósfera solar de un nuevo elemento gaseoso, el helio, que en griego significa Sol.



