| Natureduca - Portal educativo de ciencia y cultura |

Química
ESPECTROS, ÁTOMOS Y NÚCLEOS
Espectros atómicos - 1ª parte
Espectros de emisión
 uando un elemento químico en forma gaseosa o de vapor
recibe energía, bien por calentamiento a alta temperatura, bien por una descarga
eléctrica de alta tensión, emite luz que puede ser analizada mediante un
espectroscopio.
uando un elemento químico en forma gaseosa o de vapor
recibe energía, bien por calentamiento a alta temperatura, bien por una descarga
eléctrica de alta tensión, emite luz que puede ser analizada mediante un
espectroscopio.

Espectro de emisión de
hidrógeno. La imagen obtenida por un espectroscopio está compuesta por una
serie de bandas características de cada elemento químico emisor, en este
caso del hidrógeno.
El espectro del hidrógeno, por su sencillez, atrajo la atención de diferentes investigadores. Se trataba de una serie formada por quince líneas, que se van juntando cada vez más según se recorre la serie desde la región del rojo hacia la del violeta, y cuyas longitudes de onda pudieron ser medidas con bastante precisión. Estudiando esta serie, J. J. Balmer en 1885 encontró una fórmula que permitía reproducir sus líneas componentes una a una. La sencilla fórmula de Balmer era:
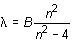
(16.1)
siendo B una constante igual a 3.646 Å y n un número entero que toma el valor 3 para la primera línea (Ha), 4 para la segunda (Hb), 5 para la tercera (Hy) y así sucesivamente. Aun cuando Balmer no dio ninguna explicación a su fórmula, fue capaz de descubrir el orden y la regularidad existente detrás de los datos experimentales.
Algunos años después, Rydberg propuso otra expresión equivalente para la fórmula de Balmer:
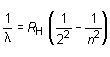
(16.2)
donde RH es la llamada constante de Rydberg cuyo valor es de 109 677,6 cm-1 y n toma los valores 3, 4, 5... La ventaja de esta expresión frente a la de Balmer consistía en sugerir la posibilidad de expresar el inverso de la longitud de onda de una línea dada o número de ondas como la diferencia entre dos términos numéricos T1 y T2:
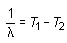
(16.3)
T1 sería fijo e igual a
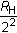 y T2 sería variable e igual a
y T2 sería variable e igual a
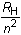 ; a medida que n aumenta T2 se hace cada vez más
pequeño, tendiendo hacia cero, con lo que
; a medida que n aumenta T2 se hace cada vez más
pequeño, tendiendo hacia cero, con lo que
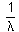 tiende
hacia T1, que
por esta razón se denomina límite de la serie.
tiende
hacia T1, que
por esta razón se denomina límite de la serie.
Los términos T1 y T2 se denominan términos espectrales y la ecuación (16.3) se conoce como principio de combinación de Rydberg y Ritz. La ecuación de Rydberg y el principio de combinación fueron más tarde generalizados en la forma:

(16.4)
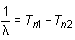
(16.5)
y permitieron describir, además de la de Balmer (n1 = 2; n2 = 3,4,5 ... ) otras series de líneas del espectro del hidrógeno que se conocen por los nombres de sus descubridores. Así, la serie de Lyman, situada en la región del ultravioleta, es descrita por la fórmula de Rydberg cuando se considera n1 = 1 y n2 = 2,3,4 ... En la serie de Paschen n1 = 3 y n2 = 4,5,6 ... ; en la de Brackett n1 = 4 y n2 = 5,6,7... y en la de Pfund n1 = 5 y n2 = 6,7,8. Estas tres últimas series están situadas en la región del infrarrojo.



