| Natureduca - Portal educativo de ciencia y cultura |

Química
ESPECTROS, ÁTOMOS Y NÚCLEOS
Espectros y estructura atómica - 5ª parte
Órbitas, niveles de energía y espectros (continuación)
 a ecuación obtenida para los niveles energéticos En
recuerda,
por su analogía, la expresión del término espectral T2 del principio de
combinación de Rydberg y Ritz.
a ecuación obtenida para los niveles energéticos En
recuerda,
por su analogía, la expresión del término espectral T2 del principio de
combinación de Rydberg y Ritz.
La fórmula de Balmer, en la versión de Rydberg (16.2), puede ser efectivamente deducida de los postulados de Bohr. Basta con combinar la ecuación (16.12) de la energía con el segundo postulado expresado en función de la longitud de onda en la forma:
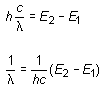
(16.13)
Sustituyendo en la anterior expresión la ecuación de la energía En para n1 y n2, resulta:

(16.14)
El cálculo efectuado a partir de las constantes K, e, me y h arrojó un valor que concordaba, dentro de la precisión con la que se conocían tales constantes físicas, con el valor de RH determinado experimentalmente a partir de la medida de las líneas de la serie de Balmer del espectro del nitrógeno. Esta confirmación espectacular del modelo de Bohr no fue la única. La ecuación (16.14) predijo la existencia de otras series distintas de las de Balmer que no habían sido observadas hasta entonces.
Fuera del rango visible en los dominios del ultravioleta y del infrarrojo, con posterioridad al desarrollo teórico de Bohr fueron observadas las series de Lyman (n1 = 1; n2 > 2), de Brackett (n1 = 4; n2 > 5), de Pfund (n1 = 5; n2 > 5) y de Humphreys (n1 = 6; n2 > 6).El desarrollo de espectroscopios más potentes reveló que las líneas del espectro del hidrógeno no son sencillas, sino que constan de una serie de componentes muy próximas entre sí. A pesar de sus éxitos iniciales, el modelo de Bohr no pudo explicar esta estructura fina de las rayas espectrales del hidrógeno. Para conseguirlo Sommerfeld y Wilson debieron modificar la descripción inicial admitiendo que las órbitas electrónicas eran elipses cuya excentricidad, o grado de aplanamiento, podía variar, y con ella la energía del electrón.
A pesar de este ajuste teórico, el modelo de Bohr no fue capaz de explicar satisfactoriamente los espectros de átomos complejos. Los físicos de la época tomaron entonces conciencia de que no podían eliminarse los defectos de este modelo introduciendo retoque tras retoque en la teoría.Era necesario renovar los propios fundamentos e idear una nueva mecánica capaz de describir el átomo y explicar completamente sus manifestaciones. Esa nueva teoría, que permite estudiar los sistemas microscópicos como el átomo y la molécula, se conoce como mecánica cuántica.



