| Natureduca - Portal educativo de ciencia y cultura |

Química
ESPECTROS, ÁTOMOS Y NÚCLEOS
Espectros y estructura atómica - 3ª parte
El átomo de Bohr (continuación)
 as siguientes ideas fundamentales,
que nacieron hibridadas de otras formulaciones,
describen lo esencial de este modelo atómico.
as siguientes ideas fundamentales,
que nacieron hibridadas de otras formulaciones,
describen lo esencial de este modelo atómico.
1. Las órbitas que describen los electrones en torno al núcleo son estacionarias, es decir, el electrón gira en ellas sin emitir ni absorber energía. A cada órbita le corresponde por tanto una energía definida e igual a la que posee el electrón cuando está en ella.
2. La emisión o la absorción de radiación por un átomo va acompañada de saltos electrónicos de una órbita a otra de diferente energía. La radiación emitida o absorbida tiene una frecuencia f tal que verifica la ecuación
E2 - E1 = hf
donde E2 y E1 representan las energías correspondientes a las órbitas entre las cuales se produce la transición, siendo h la constante de Planck.3. Las leyes de la mecánica clásica permiten explicar el carácter circular de las órbitas electrónicas, pero no las transiciones de una órbita a otra.
4. No todas las órbitas circulares están permitidas para un electrón. Sólo aquellas que satisfacen la condición
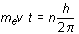
Como se pone de manifiesto en los anteriores postulados, Bohr admite la utilidad de la física clásica para explicar algunos aspectos de su modelo y a la vez la rechaza para explicar otros. El problema de la inestabilidad del átomo planteado con anterioridad para el modelo planetario de Rutherford, lo resuelve Bohr imponiendo el carácter estacionario de las órbitas, lo cual equivale a negar, en ese punto, la validez de la física clásica y aceptar la idea de cuantificación.
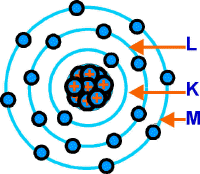
En 1913, Niels Bohr
enunció una nueva teoría que distribuía los electrones en capas de órbitas
que poseían su propio nivel de energía. En la imagen, las tres capas de un
átomo de cloro
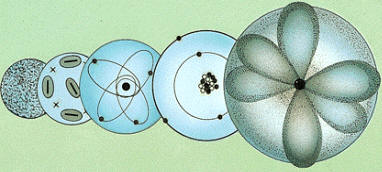
Evolución histórica del modelo
atómico: el más antiguo, presentado por Dalton en 1803, se ha ido superando
hasta llegar al modelo mecánico ondulatorio en 1932, que es el más aceptado
actualmente.



