| Natureduca - Portal educativo de ciencia y cultura |

Química
ESPECTROS, ÁTOMOS Y NÚCLEOS
El modelo de la mecánica cuántica - 1ª parte
Electrones y ondas de materia
 as ideas de De Broglie sobre la dualidad
onda-corpúsculo sirvieron de base para el desarrollo de la mecánica cuántica y
su aplicación al estudio de la organización interna del átomo.
as ideas de De Broglie sobre la dualidad
onda-corpúsculo sirvieron de base para el desarrollo de la mecánica cuántica y
su aplicación al estudio de la organización interna del átomo.
A partir del año 1925, físicos como Schrödinger por una parte y Heisenberg y Dirac por otra, construyeron sendas formulaciones de esa nueva mecánica que se conocen como mecánica ondulatoria y mecánica de matrices respectivamente. Ambas describen y explican con excelente aproximación los espectros atómicos y otros muchos fenómenos en el nivel microscópico y, aunque diferentes en su concepción matemática, pueden ser consideradas equivalentes.
Aun cuando se trata de un átomo nuclear formado por un núcleo central y un enjambre de electrones a su alrededor, el modelo atómico que aporta la mecánica cuántica es, ante todo, un modelo formal o abstracto. En él una representación pictórica detallada, como la disponible en el modelo de Bohr, deja paso a una descripción que sólo es precisa en el plano estrictamente matemático.
El comportamiento de un electrón en el interior de un átomo viene regido por la llamada ecuación de Schrödinger, una complicada ecuación matemática que describe para cada electrón la propagación de onda de materia asociada. A partir de la función de onda, obtenida al resolver la ecuación de Schrödinger, es posible determinar la probabilidad de encontrar al electrón en una posición dada y también los valores de energía que corresponden a los diferentes estados posibles del electrón.
La interpretación probabilística de las ondas de materia, que es característica de esta nueva mecánica, hace que se tenga que renunciar en el nuevo modelo de átomo, a la noción de órbita como conjunto de posiciones precisas, para sustituirlo por la de orbital como una región del espacio que rodea el núcleo atómico en donde es más probable encontrar al electrón.
Niveles de energía y números cuánticos
La cuantificación de la energía, tal y como se refleja en los espectros atómicos, fue incorporada a la mecánica ondulatoria recurriendo a la noción de ondas estacionarias. La idea inicial, debida a De Broglie, relacionaba partículas con ondas (ondas de materia).Por extensión, las situaciones en las cuales la energía de las partículas está cuantificada (sistemas atómicos), debería coincidir con aquellas otras en las que la frecuencia o la longitud de onda lo esté también (ondas estacionarias).
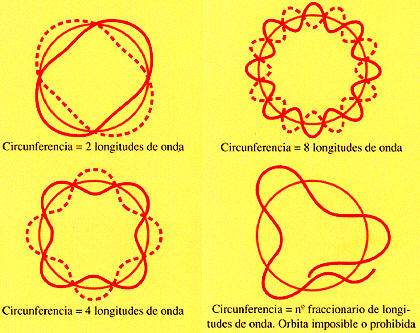
De Broglie explicó la
cuantificación de las órbitas del átomo de Bohr, admitiendo que las ondas
asociadas a un electrón deberían ser estacionarias, por lo que sólo estarían
permitidas las órbitas cuya longitud coincidiera con un número entero de
veces la longitud de su onda de materia.
La aplicación de estas ideas a las órbitas del modelo de Bohr permitió explicar la cuantificación.



