| Natureduca - Portal educativo de ciencia y cultura |

Química
ESPECTROS, ÁTOMOS Y NÚCLEOS
El modelo de la mecánica cuántica - 3ª parte
Orbitales atómicos
 egún la noción de átomo que aporta la mecánica cuántica, el
electrón no gira a distancias fijas al núcleo, sino que se halla deslocalizado
en ciertas regiones del espacio denominadas orbitales. La noción de nube
electrónica o de carga proporciona una idea gráfica de lo que representa un
orbital.
egún la noción de átomo que aporta la mecánica cuántica, el
electrón no gira a distancias fijas al núcleo, sino que se halla deslocalizado
en ciertas regiones del espacio denominadas orbitales. La noción de nube
electrónica o de carga proporciona una idea gráfica de lo que representa un
orbital.

La nube de carga equivale
al conjunto de puntos que se obtendría si se pudiese fotografiar
millones de veces un electrón en sus distintas posiciones alrededor del
núcleo atómico. La superficie límite define la región del espacio que se
conoce como orbital.
 , la cual varía con los números cuánticos
n, l y ml. La
densidad electrónica, que corresponde en la imagen de la nube de carga a la
densidad de puntos, está relacionada con el cuadrado del valor absoluto
, la cual varía con los números cuánticos
n, l y ml. La
densidad electrónica, que corresponde en la imagen de la nube de carga a la
densidad de puntos, está relacionada con el cuadrado del valor absoluto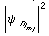
de la función de onda.
Los orbitales s tienen forma esférica y son, por lo tanto, indiferentes a la orientación (ml = 0). Los orbitales p (l = 1) presentan unas superficies límites lobuladas, distinguiéndose en cada caso tres orbitales (px, py y pz) que corresponden a las tres orientaciones ml = - 1, 0, +1.
Los orbitales d (l = 2) poseen cinco componentes (2 l + 1) orientadas en otras tantas direcciones del espacio que se representan en la forma dxy, dyz, dxz, dx2y2, dz2 y corresponden a los cinco valores del número cuántico magnéticoml = -2, -1, 0, +1, +2. Esta notación suele emplearse también para definir los niveles energéticos que caracterizan la energía de los orbitales correspondientes.



