| Natureduca - Portal educativo de ciencia y cultura |

Física
ELECTRICIDAD
Electrostática y fuentes de energía eléctrica - 10ª parte
Electricidad por acción química (continuación)
La pila primaria
 a pila seca común es la pila primaria más
ampliamente utilizada. Se denomina pila seca a causa de que su electrolito no es
líquido, sino una pasta húmeda. Si se secara totalmente no sería ya capaz de
convertir la energía química en eléctrica. El nombre de pila seca no es pues
estrictamente correcto en un sentido técnico. Cuando se combinan dos o más pilas
se tiene una batería.
a pila seca común es la pila primaria más
ampliamente utilizada. Se denomina pila seca a causa de que su electrolito no es
líquido, sino una pasta húmeda. Si se secara totalmente no sería ya capaz de
convertir la energía química en eléctrica. El nombre de pila seca no es pues
estrictamente correcto en un sentido técnico. Cuando se combinan dos o más pilas
se tiene una batería.
Proceso químico de la pila primaria
Si existiera algún método por el cual pudiésemos ver el movimiento de los electrones dentro de la pila, podríamos observar que éstos se desprenden de una placa y se desplazan en el electrolito uniéndose después a la otra placa. Como resultado, en una de las placas se acumulará un exceso de electrones, existiendo por tanto una carga negativa, y en la otra placa habrá un defecto de electrones, adquiriendo una carga positiva. Los terminales adheridos a estas placas se denominan, terminal negativo y terminal positivo.La reacción química así desarrollada convierte la energía química en cargas eléctricas, que estarán disponibles entre ambos terminales positivo y negativo en forma de diferencia de potencial. Si estos terminales no están conectados entre si, los electrones se acumularán en la placa negativa hasta que no quepan más, momento en que ambas placas estarán cargadas al máximo, cesando el movimiento de electrones entre ellas.
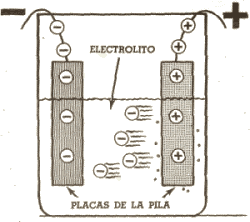
Los electrones se
desprenden de una placa (haciéndola positiva) y se unen a la otra
(haciéndola negativa), hasta un momento en que no caben más electrones.
En ese instante la pila tiene su máxima carga eléctrica.
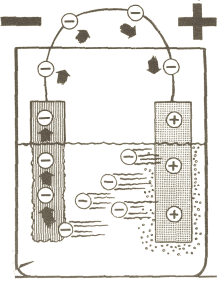
Si unimos los terminales
positivo y negativo mediante un conductor, lo electrones circulan a
través de él hacia la placa positiva, a la vez que el electrolito
transporta electrones para cubrir los huecos vacantes
La pila secundaria o acumulador
Las pilas secundarias o acumuladores funcionan por los mismos principios que las primarias. Difieren principalmente en que pueden recargarse y los elementos primarios no. Algunos de los materiales que forman las pilas secas se consumen al producir la energía eléctrica, sin embargo en la pila secundaria los materiales son simplemente transferidos de un electrodo a otro durante la descarga. La pila descargada puede ser cargada de nuevo a su estado original, haciendo que una corriente eléctrica procedente de otra fuente recorra la pila en sentido opuesto al de la corriente de descarga.La batería común consiste en un número determinado de elementos secundarios conectados en serie. El tipo más usado es de plomo, que tiene una fuerza electromotriz de 2,2 voltios por cada elemento. Es la más utilizada en los automóviles.
En condiciones de carga, los materiales activos son el peróxido de plomo (PbO2), como electrodo positivo, y plomo esponjoso (Pb), como electrodo negativo. El electrolito es una solución de ácido sulfúrico en el agua.Mientras la batería se descarga el ácido sulfúrico reacciona en ambas placas. En la placa negativa el ácido forma sulfato de plomo y deja electrones. En la placa positiva toma electrones y forma sulfato de plomo y agua. Cuando la batería está descargada, ambas placas están recubiertas de sulfato de plomo y el electrolito está convertido casi todo en agua.
Cuando se carga la batería, el efecto de la corriente es hacer que el sulfato de plomo de las dos placas vuelva a su estado original de plomo y peróxido de plomo. Al propio tiempo el sulfato es devuelto a la solución donde forma el ácido sulfúrico.



