| Natureduca - Portal educativo de ciencia y cultura |

Química
VELOCIDAD Y EQUILIBRIO EN QUÍMICA
El equilibrio químico - 3ª parte
La ley del equilibrio químico
 l principio de Le Chatelier permite predecir en qué manera se
desplazará el equilibrio químico de una reacción reversible, pero no en qué
medida.
l principio de Le Chatelier permite predecir en qué manera se
desplazará el equilibrio químico de una reacción reversible, pero no en qué
medida.
Una descripción cuantitativa del equilibrio fue efectuada por primera vez en 1870 por los químicos noruegos Guldberg (1836-1902) y Waage (1833-1918), que la expresaron en forma de ley. Así, para una reacción genérica del tipo:
aA + bB < > cC + dD
la ley de Guldberg y Waage se expresa matemáticamente en la forma:

La ley de Guldberg y Waage se conoce también como Ley de acción de masas (L.A.M.) debido a que, en el enunciado original, sus autores aludieron a conceptos tales como «fuerzas de acción» y «masas activas». Aunque el descubrimiento de esta ley fue el resultado de análisis de datos experimentales, algunos años más tarde pudo ser explicada teóricamente a partir de las leyes de la termodinámica.
La Ley de acción de masas permite hacer cálculos y predicciones sobre el equilibrio. Así, el efecto de la concentración puede explicarse como sigue: si en un sistema en equilibrio se aumenta la concentración de un reactivo, [A] por ejemplo, la reacción ha de desplazarse hacia la derecha en el sentido de formación de los productos para que el cociente representado por K se mantenga constante.Aplicando la ley de acción de masas (1)
La reacción:2NO(g) + O2(g) < > 2NO2(g)
presenta una constante de equilibrio K = 6,45 · 105 (a 500 K de temperatura). Determinar cuál ha de ser la concentración de oxígeno para que se mantenga el equilibrio en un sistema en el que las concentraciones de NO y NO2 son iguales.De acuerdo con la ley de acción de masas:
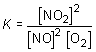
![]()
![]()



