| Natureduca - Portal educativo de ciencia y cultura |

Química
VELOCIDAD Y EQUILIBRIO EN QUÍMICA
El equilibrio químico - 2ª parte
El principio de Le Chatelier
 xiste un principio muy general que determina las posibilidades
de variación de los equilibrios químicos. Fue propuesto a finales del siglo
pasado por el químico francés Henri-Louis Le Chatelier (1850-1936), por lo que
se conoce como principio de Le Chatelier. Se puede enunciar en los
siguientes términos:
xiste un principio muy general que determina las posibilidades
de variación de los equilibrios químicos. Fue propuesto a finales del siglo
pasado por el químico francés Henri-Louis Le Chatelier (1850-1936), por lo que
se conoce como principio de Le Chatelier. Se puede enunciar en los
siguientes términos:
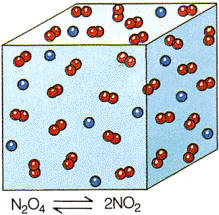
En la reacción N2O4+
calor
![]() 2NO, un aumento de temperatura desplazará el equilibrio hacia la
derecha. Parte del N2O4 se descompondrá produciendo NO, con lo que se
irá absorbiendo la energía comunicada para contrarrestar este aumento de
temperatura.
2NO, un aumento de temperatura desplazará el equilibrio hacia la
derecha. Parte del N2O4 se descompondrá produciendo NO, con lo que se
irá absorbiendo la energía comunicada para contrarrestar este aumento de
temperatura.
La ruptura del equilibrio de la reacción:
3Fe + 4H2O < > Fe3O4 + 4H2
provocada por la pérdida de H2, puede explicarse en términos análogos, ya que al disminuir la concentración de H2 la reacción se desplaza hacia la derecha para producir más hidrógeno, oponiéndose, de este modo, a dicha perturbación.Una modificación de la temperatura del sistema en equilibrio puede producir igualmente un desplazamiento del mismo en un sentido o en otro. Así, por ejemplo, la reacción:
N2O4 + calor < > 2NO2
es endotérmica, por lo que un aumento de la temperatura desplazará el equilibrio en el sentido de la reacción directa, pues es en el que absorbe calor. La reacción inversa se verá favorecida por un enfriamiento, pues en este sentido se produce calor.También los efectos de variaciones de presión, cuando el sistema posee componentes gaseosos, repercuten por análogas razones sobre el equilibrio. Así, por ejemplo, en la síntesis del amoníaco:
N2(g) + 3H2(g) < > 2NH3(g)
un aumento de presión desplazará el equilibrio hacia la derecha, ya que el número de moléculas en el segundo miembro es inferior y, por tanto, ejercerán una presión menor sobre el recipiente.



