| Natureduca - Portal educativo de ciencia y cultura |

Química
LOS IONES
Sólidos iónicos - 2ª parte
Propiedades de los sólidos iónicos
 l hecho de que las fuerzas electrostáticas responsables del enlace iónico
sean intensas y estén orientadas en las diferentes direcciones del espacio
determina la mayor parte de las propiedades características de estos sólidos.
l hecho de que las fuerzas electrostáticas responsables del enlace iónico
sean intensas y estén orientadas en las diferentes direcciones del espacio
determina la mayor parte de las propiedades características de estos sólidos.
Así, por ejemplo, todos los compuestos iónicos presentan un elevado punto de fusión por encima de los 500 C la mayoría de las veces, de modo que en las condiciones de presión y temperatura ordinarias se hallan en estado sólido. Sólo a altas temperaturas la energía térmica, que se traduce en vibración de los iones en la red, es suficiente como para vencer las fuerzas de enlace, con lo que la estructura cristalina se viene abajo y el sólido iónico se convierte en líquido.
Los sólidos iónicos se caracterizan por su dureza o dificultad para ser rayados, así como por su fragilidad, es decir, por su carácter quebradizo. Teniendo en cuenta que todo proceso de rayado implica la rotura de enlaces en el cristal, se comprenderá por qué tal operación resulta dificultosa en los compuestos iónicos; es una consecuencia de la intensidad de las fuerzas de enlace.
La fragilidad se explica del siguiente modo: si las fuerzas deformadoras están dirigidas de forma que produzcan un desplazamiento lateral de una capa iónica sobre otra, los iones del mismo signo quedan enfrentados, por lo que experimentarán una fuerte repulsión y el cristal se romperá.
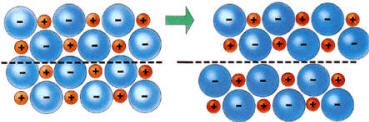
En un sólido los iones del mismo
signo, enfrentados como consecuencia de su desplazamiento lateral,
experimentarán una fuerte repulsión que terminará quebrando el cristal. Este
fenómeno explica el carácter frágil de los sólidos iónicos.
Los compuestos iónicos no son conductores de la electricidad en estado sólido, pues los iones están fuertemente ligados en la red; sin embargo, a una temperatura superior a su punto de fusión, cuando alcanzan la condición de líquido, se convierten en conductores. En tal circunstancia son los propios iones los portadores de carga que contribuyen a la formación de una corriente eléctrica, cuando se les somete a la acción de un campo eléctrico.
Asimismo, la estructura en forma de red o retícula característica de los sólidos iónicos puede quedar deshecha bajo la acción de algunos líquidos o disolventes polares como el agua. La desaparición de las uniones rígidas entre los iones que formaban la red cristalina confiere a aquéllos, en disolución, la suficiente movilidad como para poder contribuir al transporte de carga típico de la corriente eléctrica. Esta es otra propiedad característica de los sólidos iónicos, la de ser buenos conductores en disolución.



