| Natureduca - Portal educativo de ciencia y cultura |

Química
LOS IONES
Sólidos iónicos - 1ª parte
Cristales iónicos
 as fuerzas de enlace iónico son típicamente
electrostáticas, de modo que un ion Na+ ejercerá su fuerza atractiva
sobre los iones Cl- con igual intensidad en todas las direcciones del
espacio para una distancia dada.
as fuerzas de enlace iónico son típicamente
electrostáticas, de modo que un ion Na+ ejercerá su fuerza atractiva
sobre los iones Cl- con igual intensidad en todas las direcciones del
espacio para una distancia dada.
Esta característica de las fuerzas de enlace iónico da lugar a la formación de estructuras iónicas espaciales y regulares en las que cada ion está ligado a un grupo ordenado de iones de signo contrario que le rodea. Dicho número, que se conoce con el nombre de índice de coordinación, estará determinado fundamentalmente por la relación que exista entre los tamaños de los iones enlazados.
Así, por ejemplo, en el cristal de NaCl el índice de coordinación es 6, la estructura de su red cristalina es cúbica centrada en las caras y cada ion Na+ está rodeada por 6 Cl-. Sin embargo, en el cristal del CsCl el índice de coordinación es 8 y la estructura de su red cristalina es cúbica centrada en el cuerpo; en ella cada ion Cs+ está rodeado por 8 Cl-.Esta diferente estructura de ambos cristales puede explicarse como debida a que el tamaño de un ion Cl- es casi el doble que el de un ion Na+ y, sin embargo, es sólo un poco mayor que el de un ion Cs+.
Dado que la estructura más estable es la más compacta posible, es lógico que en torno a un ion mayor como es el Cs+ tengan que agruparse un mayor número de iones Cl-. Para comprender mejor este hecho basta asimilar los iones a esferas y considerar cómo influiría el tamaño de las mismas en la formación de una estructura compacta.
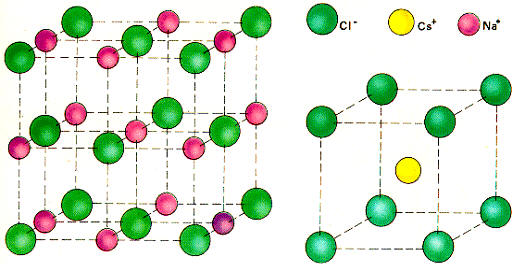
El número de iones que rodea a
otro de signo opuesto es una red cristalina y depende de la relación entre sus
radios respectivos. El radio del ion Cs+es bastante superior al del ion Na+.
Todo cristal iónico ha de ser, en conjunto, eléctricamente neutro, y por esta razón se escriben las fórmulas de los compuestos iónicos como si se tratase de moléculas cuando en realidad no lo son. Así, cuando se escribe el cloruro de cesio como CsCl se quiere indicar con ello que, en conjunto e independientemente de su ordenación en el cristal, existe un ion Cs+ por cada ion Cl-.
De igual modo, cuando los iones en cuestión difieren en su número de cargas, la fórmula se verá afectada por los correspondientes subíndices que indican la proporción de uno a otro exigida por la condición de electroneutralidad del cristal. Así, por ejemplo, el fluoruro de calcio (fluorita) está formado por la unión iónica de los iones F- y Ca2+; su fórmula viene dada por CaF2.



