| Natureduca - Portal educativo de ciencia y cultura |

Química
LOS IONES
Iones en disolución - 1ª parte
La electrólisis
 uando un sólido iónico es disuelto en agua, sus iones
componentes pueden moverse bajo la influencia de fuerzas eléctricas. Si éstas
son de signo opuesto será posible entonces separar los aniones de los cationes
presentes en la disolución.
uando un sólido iónico es disuelto en agua, sus iones
componentes pueden moverse bajo la influencia de fuerzas eléctricas. Si éstas
son de signo opuesto será posible entonces separar los aniones de los cationes
presentes en la disolución.
Esta separación de sustancias por medio de la electricidad es lo que Faraday denominó electrólisis.
A modo de ejemplo se consideran en lo que sigue los procesos de electrólisis de sendos compuestos iónicos en disolución acuosa, el cloruro de sodio o sal común (NaCl) y el nitrato de plomo (II), cuya fórmula química viene dada por Pb(NO3)2, y que pueden ser estudiados experimentalmente mediante un dispositivo como el que se muestra en la ilustración.
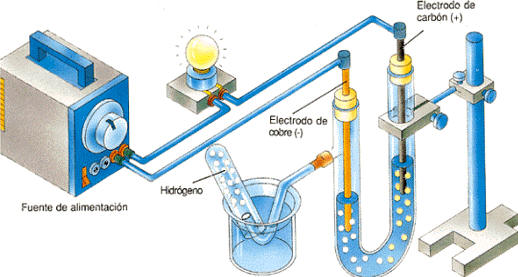
La electrólisis del NaCL y del
Pb(NO3)2
en disolución acuosa puede efectuarse empleando en ambos casos el mismo tipo de
electrodos, una varilla de carbono como electrodo positivo y una de cobre como
electrodo negativo.
La disociación del sólido iónico Pb(NO3)2 en sus iones componentes por mediación del agua puede escribirse en la forma:
Pb(NO3)2
![]() Pb2+ +2
NO3-
Pb2+ +2
NO3-
(18.3)
Pb2+ NO3- deben ser, en principio, las partículas que viajan por la disolución hacia sus respectivos electrodos. Si como se observa experimentalmente, en el electrodo negativo o de cobre se deposita plomo, el gas incoloro que se desprende del electrodo positivo o de carbono debe proceder del NO3- o del producto de alguna reacción de éste con el agua de la disolución.
Por su parte, la electrólisis del cloruro de sodio produce en el electrodo de cobre un gas incoloro, inodoro e inflamable y en el electrodo de carbono un gas de color amarillo verdoso que puede identificarse con el cloro.
La ecuación química que describe la disociación del NaCl en agua puede escribirse en la forma:
NaCl
![]() Na+
+ Cl-
Na+
+ Cl-
(18.4)
El hecho de que no se aprecie un depósito de sodio en el electrodo de cobre y sí un desprendimiento gaseoso, indica que tiene lugar algún proceso químico más complejo.
En la página siguiente detendremos nuestra atención, por su sencillez, en lo que sucede en el electrodo de cobre de la electrólisis del Pb(NO3)2 y en el electrodo de carbono de la electrólisis del NaCl.



