| Natureduca - Portal educativo de ciencia y cultura |

Química
LOS IONES
Iones en disolución - 2ª parte
La electrólisis (continuación)
 uando los iones Pb2+ atraídos por el cátodo alcanzan la superficie del cobre
reciben dos electrones de éste y se convierten en plomo metálico, es decir:
uando los iones Pb2+ atraídos por el cátodo alcanzan la superficie del cobre
reciben dos electrones de éste y se convierten en plomo metálico, es decir:
Pb2+ + 2 e-
![]() Pb
Pb
(18.5)
Por su parte, cuando los iones Cl- alcanzan el electrodo de carbono o ánodo ceden un electrón y se convierten en cloro gaseoso:
2 Cl-
![]() Cl2 (gas) + 2
e-
Cl2 (gas) + 2
e-
(18.6)
Cabe preguntarse por qué motivo no se producen reacciones tan directas en los electrodos de carbono y es de tipo energético. Mientras que los procesos representados por las expresiones (18.5) y (18.6) requieren poca energía, los correspondientes en cada caso a los iones de signo opuesto requieren mayor cantidad de energía que otros más complejos que implican la participación del agua de la disolución y que son los responsables de un desprendimiento de oxígeno en el electrodo de carbono en la electrólisis del Pb(NO3)2 y de hidrógeno en el electrodo de cobre en la del NaCl.
El depósito de iones metálicos en el cátodo de una cuba electrolítica constituye el fundamento de una de las aplicaciones industriales de la electrólisis. Un objeto de metal de baja calidad puede recubrirse con una capa fina de un metal valioso mejorando de este modo su apariencia y protegiéndolo de la corrosión. Para ello se emplea dicho objeto metálico como cátodo y se recurre a una disolución electrolítica que contenga como catión el metal con el que se desea bañar el objeto y a un ánodo formado por dicho metal.
Activada la electrólisis mediante la correspondiente fuente de alimentación de corriente continua, se consigue trasvasar el metal valioso de uno a otro electrodo a través de la disolución. El cromado, el plateado o el niquelado son algunos ejemplos de recubrimiento electrolítico con metales que se conoce también como galvanostegia.
Las leyes de Faraday
Estudios sistemáticos del fenómeno de la electrólisis llevaron a Faraday a descubrir la existencia de una relación de proporcionalidad directa entre la cantidad de sustancia que se separa o se deposita en los electrodos y el producto de la intensidad de corriente que pasa por la disolución por el tiempo que dura dicha corriente. Además estableció que la cantidad de electricidad (carga eléctrica) necesaria para depositar una masa del ion considerado igual al cociente entre su mol y su carga neta es la misma para todas las sustancias e igual al faraday.
Ambas conclusiones se conocen como leyes de Faraday y en términos matemáticos pueden ser expresadas mediante una sola relación en la forma:
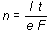
(18.7)
donde n es el número de moles depositados en el electrodo, I t es la carga total en coulombs que circula por la disolución y F es esa cantidad de carga denominada faraday, que equivale a la carga eléctrica de un mol de electrones, es decir:
1 faraday = NA e- = 96.486 C
Finalmente e representa, en la fórmula, el número de cargas del ion en cuestión.
Aplicación de las leyes de Faraday
Se desea recubrir electrolíticamente una moneda metálica con una capa de cobre, para lo cual se necesita que se depositen sobre ella 1,200 g de cobre metálico. Se emplea como cátodo la moneda y como electrolito una disolución de sulfato de cobre (II) (CuSO4) y se aplica a la cuba una tensión eléctrica que produce una corriente de 0,4 A. Calcúlese el tiempo que debe durar el proceso para conseguir el depósito deseado. (Masa atómica del cobre: MCu = 63,54).
De acuerdo con las leyes de Faraday:
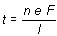
n es el número de moles depositados en la moneda, que en este caso se obtendrá de la forma:

e es el número de carga del ion que se deposita, que para el cobre (Cu2+ + 2e-
![]() Cu) es igual a 2.
Cu) es igual a 2.
F es el valor del Faraday como unidad de carga, es decir, F = 96 486 C.
I es la intensidad de corriente igual a 0,4 A.
Sustituyendo los valores anteriores en la expresión de t resulta: