| Natureduca - Portal educativo de ciencia y cultura |

Química
LOS IONES
Oxidación y reducción - 4ª parte
El proceso de la pila electroquímica ilustrado paso a paso
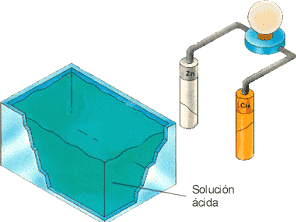
Tenemos una pila electroquímica, compuesta por una cuba que contiene una solución ácida, una varilla de cinc (Zn) y otra de Cobre (Cu) conectadas ambas a una bombilla mediante unos conductores.
Inicialmente el conjunto de varillas, conductor y bombilla está fuera de la cuba. Al introducir en ella las varillas se inicia el proceso.
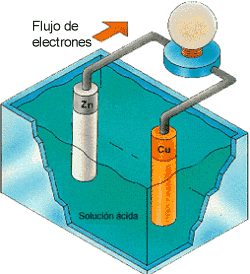
Al introducir las varillas en la solución ácida de la cuba, en el electrodo de Zn se liberan electrones que pasan a través del hilo conductor hacia el electrodo de Cu donde son captados por los iones hidrógeno.
Zn
![]() Zn2+ + 2e+
Zn2+ + 2e+
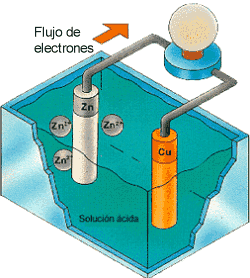
Ahora, los cationes Zn2+ pasan a formar parte de la disolución
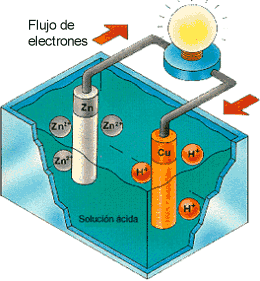
2H+ - 2e-
![]() H2
H2
La varilla de cobre (Cu) se comporta como un polo positivo y la de cinc (Zn) como uno negativo, y junto con la disolución constituyen una pila electroquímica. En ella, la energía química se ha transformado en energía eléctrica.



