| Natureduca - Portal educativo de ciencia y cultura |

Química
LOS IONES
Oxidación y reducción - 3ª parte
Pilas y acumuladores (continuación)
 a varilla de cobre se comporta como un polo positivo y la de cinc como uno
negativo y junto con la disolución constituyen una pila electroquímica. En ella,
de forma inversa a la electrólisis, la energía química se ha transformado en
energía eléctrica y los iones han jugado un papel importante en el proceso.
a varilla de cobre se comporta como un polo positivo y la de cinc como uno
negativo y junto con la disolución constituyen una pila electroquímica. En ella,
de forma inversa a la electrólisis, la energía química se ha transformado en
energía eléctrica y los iones han jugado un papel importante en el proceso.
Este mismo tipo de reacciones redox es el fundamento de los acumuladores de plomo, componentes característicos de las baterías de automóvil. En este caso cada elemento de la batería está formado por un electrodo de plomo metálico, un electrodo de dióxido de plomo y una solución electrolítica de ácido sulfúrico
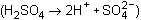
Las reacciones redox que acontecen en cada uno de los electrodos en el proceso de descarga son las siguientes:
En el cátodo: (-)

(disolución)
En el ánodo: (+)
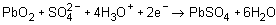
(disolución)
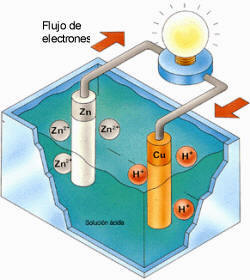
En la pila electroquímica,
en el electrodo de cinc se liberan electrones que pasan a través del
hilo conductor hacia el electrodo de cobre, donde son captados por los
iones hidrógeno de la disolución, generándose una corriente eléctrica
capaz de encender la bombilla.
Cuando la batería está conectada a un receptor el proceso de descarga correspondiente supone la circulación de los electrones a través de la disolución desde el cátodo hasta el ánodo.
En el proceso de carga de la batería por el alternador o la dinamo se invierten los sentidos de los anteriores procesos redox y la energía química es restituida al sistema. Las pilas secas que se emplean habitualmente en las linternas se basan también en este mismo principio electroquímico.



