| Natureduca - Portal educativo de ciencia y cultura |

Química
LOS IONES
Oxidación y reducción - 2ª parte
Los procesos de oxidación-reducción (continuación)
 n definitiva, lo explicado en la página anterior se
resume en que el agente oxidante, que en este tipo de reacciones es el oxígeno,
ha arrancado electrones a los átomos metálicos Na y Ca y, por tanto, los ha
oxidado también desde un punto de vista electrónico. A su vez el oxígeno al
ganar electrones en el proceso se ha reducido.
n definitiva, lo explicado en la página anterior se
resume en que el agente oxidante, que en este tipo de reacciones es el oxígeno,
ha arrancado electrones a los átomos metálicos Na y Ca y, por tanto, los ha
oxidado también desde un punto de vista electrónico. A su vez el oxígeno al
ganar electrones en el proceso se ha reducido.
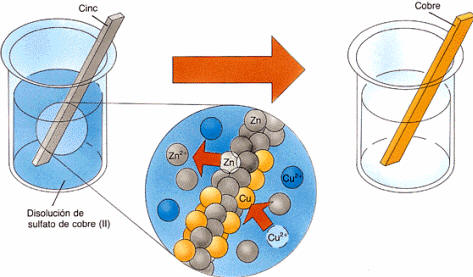
Los procesos de
oxidación-reducción suponen la transferencia de electrones de una sustancia a
otra. En el ejemplo, tenemos una disolución acuosa de sulfato de cobre (II) (CuSO4),
de forma que el cobre se reduce mientras que el cinc se oxida.
Los procesos de oxidación, cuando se consideran desde el punto de vista de lo que les sucede a cada uno de los elementos en juego, implican una oxidación y una reducción acopladas. Si A oxida a B, B reduce a A, de ahí que se les denomine genéricamente procesos redox (reducción-oxidación). Los procesos redox están condicionados por las energías que implican, y éstas, a la vez, por la configuración electrónica de los átomos en juego.
Los metales con pocos electrones en su última capa tenderán a oxidarse para adquirir la configuración estable tipo gas noble. Los no metales, que necesitan pocos electrones para completar su última capa, tenderán a reducirse por igual motivo. De ahí que la combinación de ambos tipos de elementos, metales y no metales, esté favorecida energéticamente.
Pilas y acumuladores
Al introducir en agua acidulada una varilla de cinc unida mediante un hilo conductor a una varilla de cobre, algunos de los átomos de cinc son oxidados, pasando a formar parte de la disolución en forma de cationes Zn2+ según la ecuación:
Zn
![]() Zn2+ + 2e-
Zn2+ + 2e-
(18.8)
La oxidación tiene lugar en este electrodo y no en el de cobre debido a que el cinc presenta una mayor tendencia a ceder electrones que el cobre.
En la varilla de cobre tiene lugar una reducción de los iones hidrógeno (H+) de la disolución:
2H+
+ 2e-
![]() H2
H2
(18.9)
Así, los electrones que se liberan en el electrodo de cinc (18.8) pasan a través del hilo conductor hacia el electrodo de cobre para ser captados por los iones hidrógeno (18.9), generándose una corriente eléctrica.



