| Natureduca - Portal educativo de ciencia y cultura |

Química
ENERGÍA Y REACCIÓN QUÍMICA
La ley de Hess - 3ª parte
Calor de reacción y energía de enlace
 a energía de enlace es la cantidad de energía que se libera en la formación
de un enlace entre átomos cuando reaccionan en estado gaseoso. Constituye una
medida de la fuerza del enlace covalente; así, por ejemplo, a un enlace sencillo
carbono-carbono le corresponde una energía de enlace de -83,1 kcal/mol; a uno
doble -147 kcal/mol y a uno triple -194 kcal/mol.
a energía de enlace es la cantidad de energía que se libera en la formación
de un enlace entre átomos cuando reaccionan en estado gaseoso. Constituye una
medida de la fuerza del enlace covalente; así, por ejemplo, a un enlace sencillo
carbono-carbono le corresponde una energía de enlace de -83,1 kcal/mol; a uno
doble -147 kcal/mol y a uno triple -194 kcal/mol.
Desde el punto de vista de la termoquímica, se puede interpretar como la variación de entalpía H correspondiente a una reacción del tipo:
A(g) + B(g)
![]() A - B(g)
A - B(g)
efectuada en condiciones de 1 atm de presión y 298 K de temperatura, siendo
A
y B los átomos considerados. La energía de enlace
![]() H(A - B) es siempre negativa,
pues en la unión disminuye el contenido energético del sistema, haciéndose más
estable.
H(A - B) es siempre negativa,
pues en la unión disminuye el contenido energético del sistema, haciéndose más
estable.
La aplicación de la ley de Hess permite determinar el calor de reacción a partir de las energías de enlace y viceversa. Como ejemplo de la primera posibilidad puede considerarse el cálculo del calor de reacción del proceso:
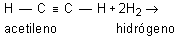
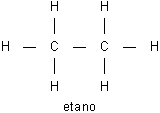
en el cual se rompen dos enlaces H --- H y un enlace C C y aparecen un enlace C --- C y cuatro enlaces H --- C nuevos. El balance global de estas operaciones parciales en términos de variación del contenido energético será:
![]() Hf =
Hf =
![]() H(C --- C) + 4
H(C --- C) + 4![]() H(C
--- H) - [
H(C
--- H) - [![]() H(C C)
+ 2
H(C C)
+ 2![]() H(H
--- H)]
H(H
--- H)]
A partir de las energías de enlace correspondientes, supuestas conocidas, se calcula entonces el calor de reacción.
Como ejemplo de la segunda posibilidad, se presenta el cálculo de la energía
de enlace H --- Cl a partir del calor de formación
![]() Hf del HCI y de las energías
de los enlaces H --- H y Cl --- Cl (supuestas conocidas).
Hf del HCI y de las energías
de los enlaces H --- H y Cl --- Cl (supuestas conocidas).
La formación del HCI puede efectuarse por los siguientes caminos:
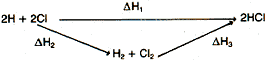
De acuerdo con la ley de Hess:
![]() H1 =
H1 =
![]() H2 +
H2 +
![]() H3
H3
en donde,
![]() H1 = 2
H1 = 2![]() H(H
--- Cl)
H(H
--- Cl)
![]() H2 =
H2 =
![]() H(H
--- H) +
H(H
--- H) +
![]() H(Cl
--- CI)
H(Cl
--- CI)
![]() H3 = 2
H3 = 2![]() Hf
Hf
por tanto: