| Natureduca - Portal educativo de ciencia y cultura |

Química
ENERGÍA Y REACCIÓN QUÍMICA
La ley de Hess - 1ª parte
El calor de formación y el calor de reacción
 l calor de formación
l calor de formación
![]() Hf de una sustancia química
representa la energía liberada o consumida durante la formación de dicha
sustancia, en condiciones normales, a partir de los elementos que la
constituyen.
Hf de una sustancia química
representa la energía liberada o consumida durante la formación de dicha
sustancia, en condiciones normales, a partir de los elementos que la
constituyen.
Si en tales condiciones se consideran nulos los contenidos energéticos
H de
los elementos, el calor de formación
![]() Hf de un compuesto coincide con su
contenido energético o entalpía. Si se compara la definición de calor de
formación con la de calor de reacción se observa que el calor de formación es un
tipo particular de calor de reacción (el correspondiente a reacciones de
formación o de síntesis de un compuesto).
Hf de un compuesto coincide con su
contenido energético o entalpía. Si se compara la definición de calor de
formación con la de calor de reacción se observa que el calor de formación es un
tipo particular de calor de reacción (el correspondiente a reacciones de
formación o de síntesis de un compuesto).
La determinación de calores de reacción puede efectuarse de un modo experimental si la reacción correspondiente se lleva a cabo de forma aislada y controlada en el interior de un calorímetro. Sin embargo, en ocasiones, esto no es posible porque tienen lugar varias reacciones simultáneamente, y no una sola.
En tales casos es posible determinarlos de una forma indirecta, recurriendo a una propiedad de la entalpía; el hecho de que H sea una función de estado, esto es, que dependa exclusivamente de los estados inicial y final del sistema, permite calcular calores de reacción a partir del conocimiento de procesos intermedios.
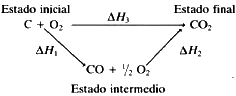
Ley de Hess
El calor de formación
![]() H1 del monóxido de carbono, CO:
H1 del monóxido de carbono, CO:
C (grafito, s) + 1/2 O2 (g)
![]() CO (g)
CO (g)
![]() H1
H1
no puede determinarse directamente porque en las condiciones en que se produce, parte del CO se transforma en CO2. Sin embargo, sí que es posible medir directamente, con la ayuda del calorímetro, los calores de reacción de los siguientes procesos:
CO(g) + 1/2 O2 (g)
![]() CO2 (g)
CO2 (g)
![]() H1
H1
![]() H2
= - 282,6 kJ/mol
H2
= - 282,6 kJ/mol
C (grafito, s) + O2
(g)
![]() CO2 (g)
CO2 (g)
![]() H3
= - 392,9 kJ/mol
H3
= - 392,9 kJ/mol
El conjunto de estas tres reacciones puede escribirse en la forma: