| Natureduca - Portal educativo de ciencia y cultura |

Química
ENERGÍA Y REACCIÓN QUÍMICA
La ley de Hess - 2ª parte
Ley de Hess (continuación)
 ado que el efecto térmico de una reacción no depende del camino, sino sólo
de los estados inicial y final, se podrá escribir:
ado que el efecto térmico de una reacción no depende del camino, sino sólo
de los estados inicial y final, se podrá escribir:
![]() H3 =
H3 =
![]() H1 +
H1 +
![]() H2
H2
y por tanto:
![]() H1 =
H1 =
![]() H3 -
H3 -
![]() H2 = -392,9 + 282,6 = 110,3 kJ/mol
H2 = -392,9 + 282,6 = 110,3 kJ/mol
Dicho de otro modo, cuando una reacción C + 1/2 O2
![]() CO escribirse como la suma algebraica (suma con signos) de otras reacciones:
CO escribirse como la suma algebraica (suma con signos) de otras reacciones:
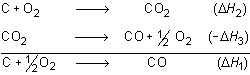
su calor de reacción es la suma algebraica de los calores de tales reacciones
(![]() H1 =
H1 =
![]() H2 -
H2 -
![]() H3). O en otros términos: el calor de la reacción de un
determinado proceso químico es siempre el mismo, cualquiera que sea el camino
seguido por la reacción, o sus etapas intermedias.
H3). O en otros términos: el calor de la reacción de un
determinado proceso químico es siempre el mismo, cualquiera que sea el camino
seguido por la reacción, o sus etapas intermedias.
El contenido de este enunciado recibe el nombre de Ley de Hess. De acuerdo con esa misma ley, los calores de reacción pueden calcularse a partir de los calores de formación de reactivos y productos.
El siguiente diagrama representa los procesos de formación y reacción de reactivos y productos, y sus relaciones en términos energéticos:

Aplicando la ley de Hess a los dos diferentes caminos que conectan reactivos y productos e igualando ambos términos resulta:
![]() H = -
H = -![]() Hf (reactivos) + 0 +
Hf (reactivos) + 0 +
![]() Hf
(productos)
Hf
(productos)
es decir:
![]() H =
H =
![]() Hf (productos) -
Hf (productos) -
![]() Hf
(reactivos)
Hf
(reactivos)
Por tanto, el calor de reacción de un proceso químico resulta ser igual a la diferencia entre los calores de formación de los productos y los calores de formación de los reactivos:
![]() H = (suma calores de formación de prod.)
- (suma calores de formación de react.)
H = (suma calores de formación de prod.)
- (suma calores de formación de react.)



