| Natureduca - Portal educativo de ciencia y cultura |

Química
ACIDEZ Y BASICIDAD
El equilibrio químico ácido-base - 3ª parte
Fuerza de ácidos y bases
 egún los conceptos de ácido y de base de Brönsted y Lowry la
fuerza de un ácido se mide por su tendencia a ceder protones y la de una base
por su tendencia a aceptarlos, pero también se puede definir por referencia al
equilibrio de disociación en disolución acuosa.
egún los conceptos de ácido y de base de Brönsted y Lowry la
fuerza de un ácido se mide por su tendencia a ceder protones y la de una base
por su tendencia a aceptarlos, pero también se puede definir por referencia al
equilibrio de disociación en disolución acuosa.
HA + H2O < > A-(aq) + H3O+(aq)
y la constante Ka de disociación del ácido vendrá dada por:
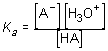
Si el ácido es fuerte, su tendencia a ceder protones desplazará considerablemente el equilibrio hacia la derecha y la disociación será prácticamente total, lo que se reflejará en un valor elevado de Ka.
Análogamente se tendrá para una base genérica B:B + H2O < > BH+(aq) + OH-(aq)
y la constante de disociación de la base o constante de basicidad será, en este caso:
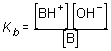
En general, para una reacción del tipo
ácido 1 + base 2 < > ácido 2 + base 1
si el ácido 1 es más fuerte que el ácido 2 la reacción estará desplazada hacia la derecha y viceversa. Lo mismo sucederá con la base 2 respecto de la base 1.
La longitud o la energía del
enlace A-H determina la fuerza del ácido; cuanto mayor es el volumen
del resto atómico A más alejado está el H y mayor es la facilidad de éste para
desprenderse.



