| Natureduca - Portal educativo de ciencia y cultura |

Química
ACIDEZ Y BASICIDAD
El equilibrio químico ácido-base - 1ª parte
El equilibrio ácido-base del agua
 a cesión de protones por un ácido y la aceptación de
protones por una base son procesos reversibles.
a cesión de protones por un ácido y la aceptación de
protones por una base son procesos reversibles.
Dado que este tipo de procesos desembocan al cabo de un cierto tiempo en una situación de equilibrio, su estudio puede efectuarse aplicando los conceptos fundamentales del equilibrio químico.

Los indicadores de pH son
sustancias colorantes cuyo color varía con el grado de acidez de la disolución.
Dicha variación de color es la consecuencia visible de una reacción química que
modifica la estructura de la molécula del indicador.
H2O + H2O
< > H3O+ + OH-
base 1 ácido 2 ácido 1 base 2
Como pone de manifiesto la escasa conductividad del agua pura, el equilibrio iónico del agua está considerablemente desplazado hacia la izquierda, lo que significa que, de acuerdo con la ley de acción de masas, su constante de equilibrio K es muy pequeña:
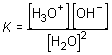
![]()
K [H2O]2 = [H3O+] [OH-]
y operando, resulta:3,2 · 10-18 · (55,5)2 = [H3O+] [OH-]C
10-14 = [H3O+] [OH-]



