| Natureduca - Portal educativo de ciencia y cultura |

Física
ELECTRICIDAD
Estructura de la materia - 3ª parte
El átomo
 a idea de que la materia está compuesta de
átomos data de hace más de 2000 años, de los griegos (véase el artículo sobre
los antecedentes históricos). Pasaron muchos siglos
antes de que el estudio derivado de esta idea básica de la estructura atómica
fuera asumido como correcto. Los físicos han explorado el interior del átomo y
encontrado más divisiones en él. El cuerpo central del átomo se denomina núcleo
y la mayor parte de la masa del átomo está concentrado en él. El núcleo está
formado por protones (partículas con cargas positivas), y neutrones que son
eléctricamente neutros.
a idea de que la materia está compuesta de
átomos data de hace más de 2000 años, de los griegos (véase el artículo sobre
los antecedentes históricos). Pasaron muchos siglos
antes de que el estudio derivado de esta idea básica de la estructura atómica
fuera asumido como correcto. Los físicos han explorado el interior del átomo y
encontrado más divisiones en él. El cuerpo central del átomo se denomina núcleo
y la mayor parte de la masa del átomo está concentrado en él. El núcleo está
formado por protones (partículas con cargas positivas), y neutrones que son
eléctricamente neutros.
El peso atómico de un elemento es esencialmente la masa de protones y neutrones de su núcleo. El número atómico de un elemento indica el número de electrones en órbita alrededor del núcleo.
Tres tipos de átomos
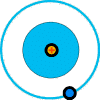
Hidrógeno (1 protón, 1 electrón)
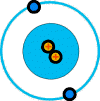
Helio(2 protones, 2 electrones)
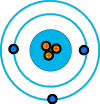
Litio (3 protones, 3
electrones)
Una de las leyes fundamentales de la electricidad es que las cargas iguales se repelen y que las cargas distintas se atraen. Esta ley explica el vínculo que existe en un átomo entre las cargas positivas del núcleo y los electrones de las órbitas.
De acuerdo con la teoría de Bohr, los electrones están situados en capas. La única característica de una capa es que contiene un número determinado de electrones como máximo. Puede tener menos, pero no más que dicho número. Solamente 2 electrones pueden ocupar la capa K, que la primera. Estos electrones están fuertemente ligados al núcleo. La siguiente capa es la L, que estando completa alberga 8 electrones. Las capas M y N tienen 18 y 32 electrones respectivamente. Los átomos más complejos y pesados tienen otras capas después de la N, pero su estudio no es necesario aquí para el conocimiento general de la estructura atómica.Si comparamos los átomos de la figura anterior, podemos ver que el átomo de helio es como el de hidrógeno, pero con una carga más positiva en el núcleo y un electrón más en la órbita. Esa órbita es la primera capa (K), y este segundo electrón completa dicha capa. Por su parte, el átomo de litio tiene un protón más en el núcleo y un electrón más en órbita, pero como la primera capa (K) no puede albergar más de 2 electrones, tal como especifica la teoría de Bohr, entonces el tercer electrón tiene que ocupar la siguiente capa (L), por eso los electrones están distribuidos en dos órbitas distintas.



