| Natureduca - Portal educativo de ciencia y cultura |

Química
MATERIA Y REACCIÓN QUÍMICA
Masa y volumen en las reacciones químicas - 2ª parte
Masa y energía (continuación)
 omo ya se dijo en la página anterior, la fórmula
omo ya se dijo en la página anterior, la fórmula
![]() E = m ·
c2 indicaba que todo cambio de
materia, y también en los procesos químicos, la absorción o la liberación de
energía implicaría también un aumento o disminución de la masa del sistema.
Luego se pondría en duda la teoría de la conservación de la masa.
E = m ·
c2 indicaba que todo cambio de
materia, y también en los procesos químicos, la absorción o la liberación de
energía implicaría también un aumento o disminución de la masa del sistema.
Luego se pondría en duda la teoría de la conservación de la masa.
Lo que sucede, sin embargo, es que debido a la enorme magnitud de la constante c2 las variaciones de energía que se producen en las reacciones químicas se corresponden con cambios de masa ínfimos que no pueden ser detectados ni por las balanzas analíticas más precisas. Se hace así buena la afirmación de Hans Landolt, uno de los químicos que pusieron a prueba la ley de Lavoisier, quien en 1909 afirmaba:
«La prueba experimental de la ley de conservación de la masa puede considerarse completa. Si existe alguna desviación será menor de la milésima de gramo.»
La ley de Lavoisier sigue, por tanto, siendo válida, al menos en términos prácticos, en el dominio de la química.
En las reacciones nucleares, sin embargo, las energías liberadas son mayores y la ley de conservación de la masa se funde con la de conservación de la energía en un solo principio. La ley de Lavoisier generalizada con la importante aportación de Einstein, puede escribirse en la forma:
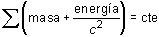
que indica que, en un sistema cerrado, la suma de las masas incrementada en el término equivalente de energía se mantiene constante.
Las proporciones en masa en las combinaciones químicas
El estudio de las cantidades en las que diferentes sustancias participan en una reacción química fue objeto de la atención de los primeros químicos. Junto con Lavoisier, Proust (1754-1826), Dalton (1766-1844) y Richter (1824-1898) enunciaron diferentes leyes que en conjunto se conocen como leyes ponderales o relativas al peso.
La utilización del concepto de peso en química sería sustituida más adelante por el de masa, de modo que las leyes ponderales hacen referencia a las proporciones en masa características de las combinaciones químicas. Dichas leyes fueron enunciadas en su mayoría, antes de que se dispusiese de un modelo atómico sobre la constitución de la materia y contribuyeron notablemente a la formulación por Dalton de dicho modelo.
La ley de Proust o de las proporciones definidas o constantes: Cuando dos o más elementos se combinan para formar un compuesto lo hacen en una relación ponderal (o de masas) fija y definida.
Esta ley indica que la composición de una combinación es siempre la misma y que, por lo tanto, el porcentaje o proporción en la que intervienen los diferentes elementos es constante y característica de la sustancia compuesta considerada. Así en el amoníaco (NH3) la proporción en masa nitrógeno/hidrógeno es de 4,67:1 cualquiera que sea la muestra que se considere.
La ley de Dalton o de las proporciones múltiples: Cuando dos elementos se unen para formar más de un compuesto, las cantidades de un mismo elemento que se combinan con una cantidad fija del otro, guardan entre sí una relación que corresponde a números enteros sencillos.



