| Natureduca - Portal educativo de ciencia y cultura |

Química
MATERIA Y REACCIÓN QUÍMICA
Ecuaciones químicas - 2ª parte
El ajuste de las ecuaciones químicas
 l conocimiento de cuestiones tales como qué productos cabe esperar a partir
de unos reactivos determinados, qué reactivos darán lugar a ciertos productos o incIuso si una reacción dada es o no posible, son cuestiones que se aprenden con
la práctica.
l conocimiento de cuestiones tales como qué productos cabe esperar a partir
de unos reactivos determinados, qué reactivos darán lugar a ciertos productos o incIuso si una reacción dada es o no posible, son cuestiones que se aprenden con
la práctica.
Sin embargo, conocidos los reactivos y los productos, el ajuste de la reacción correspondiente constituye una mera consecuencia de la ley de Lavoisier de conservación de la masa. Además ésta es una operación previa a la realización de muchos de los problemas de química básica.
Uno de los procedimientos habituales empleados para ajustar una reacción química puede describirse en los siguientes términos:
1. Se escribe la reacción química en la forma habitual:
reactivos
![]() productos
productos
2. Se cuenta el número de átomos de cada elemento en uno y otro miembro de la ecuación. Si son iguales para cada uno de los elementos presentes, la ecuación está ajustada.
3. Si no es así, será preciso multiplicar las fórmulas de los reactivos y productos por ciertos coeficientes tales que produzcan la igualdad numérica deseada. La búsqueda de este conjunto de coeficientes puede hacerse mediante tanteos. No obstante, este procedimiento de ensayo y error no siempre es efectivo y puede ser sustituido por otro más sistemático, que equivale a plantear un sistema de ecuaciones con dichos coeficientes como incógnitas.
Tornando como ejemplo de referencia la reacción de combustión del propano:
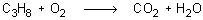
estos serían los pasos a seguir:
a) Se fijan unos coeficientes genéricos a, b, c, d:
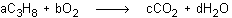
b) Se impone la ley de conservación de la masa a nivel atómico, para lo cual se iguala, para cada elemento diferente, el producto de su subíndice por su coeficiente, en ambos miembros de la ecuación química:
Para el C 3a = c
Para el H 8a = 2d
Para el O 2b = 2c + d
c) Se resuelve el sistema. Si, como en el ejemplo, el número de coeficientes es superior en una unidad al de elementos, entonces se iguala cualquiera de ellos a uno. Si una vez resuelto el sistema, los coeficientes resultantes fueran fraccionarios, se convierten en enteros multiplicando todos ellos por su mínimo común denominador:
a = 1 b = 5 c = 3 d = 4
d) Se sustituyen los valores en la ecuación de partida y se comprueba que el ajuste es correcto mediante el correspondiente recuento de átomos de cada elemento en uno y otro miembro de la ecuación química: