| Natureduca - Portal educativo de ciencia y cultura |

Química
LOS IONES
Introducción - 2ª parte
Un poco de historia
 l estudio de la composición de las sustancias químicas
llevó al químico inglés Humphry Davy (1778-1829) a investigar la influencia de
la corriente eléctrica en la separación de diferentes sustancias compuestas.
Ensayó infructuosamente con sustancias sólidas para más tarde probar con las
mismas sustancias fundidas. El paso de la corriente alimentada por una potente
batería construida a propósito permitió finalmente a Davy separar diferentes
compuestos en sus elementos constituyentes.
l estudio de la composición de las sustancias químicas
llevó al químico inglés Humphry Davy (1778-1829) a investigar la influencia de
la corriente eléctrica en la separación de diferentes sustancias compuestas.
Ensayó infructuosamente con sustancias sólidas para más tarde probar con las
mismas sustancias fundidas. El paso de la corriente alimentada por una potente
batería construida a propósito permitió finalmente a Davy separar diferentes
compuestos en sus elementos constituyentes.
Michel Faraday (1791-1867), discípulo de Davy, extendió los estudios de su maestro a disoluciones e introdujo, por primera vez, el nombre de electrólisis para referirse a la separación o ruptura de sustancias compuestas mediante la corriente eléctrica. La observación de que las disoluciones salinas eran capaces de conducir la corriente eléctrica llevó a Faraday a considerar que deberían existir en tales disoluciones partículas cargadas cuyo movimiento entre los dos conductores extremos o electrodos, colocados dentro de la disolución, constituiría la corriente eléctrica. A tales partículas cargadas las llamó iones, que en griego significa viajero. El electrodo positivo recibió el nombre de ánodo; hacia él viajarían los iones negativos que llamó aniones. Por su parte el electrodo negativo o cátodo atraería a los iones positivos, que por dirigirse al cátodo los denominó cationes.
El concepto de ion
Un ion es un átomo o grupo de átomos cargado eléctricamente. Un ion positivo es un catión y un ion negativo es un anión.
La formación de los iones a partir de los átomos es, en
esencia, un proceso de pérdida o ganancia de electrones. Así, cuando un átomo
como el de sodio (Na) pierde un electrón (e-)
se convierte (![]() )
en el catión Na+:
)
en el catión Na+:
Na - 1 e-
![]() Na+
Na+
(18.1)
Si un átomo de oxígeno gana dos electrones se convierte en el anión O2- :
O + 2 e-
![]() O2-
O2-
(18.2)
Cuando un ion sencillo se une con moléculas neutras o con otro ion de signo opuesto que no compensa totalmente su carga, se forma un ion complejo. Tal es el caso del ion amonio NH4+ producido por la unión del ion hidrógeno con la molécula de amoníaco NH3:
H + NH3
![]() NH4+
NH4+
o del ion hidronio formado por la unión del ion hidrógeno con la molécula de agua H2O:
H+
+ H2O
![]() H3O+
H3O+
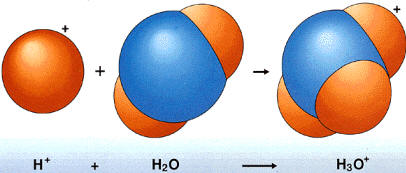
Un ión hidronio. Los iones
son átomos o grupos de átomos que han perdido su neutralidad eléctrica
característica. H+
es un ion
simple que puede unirse a una molécula de agua para formar un ion
complejo, el ion hidronio H3O+
Aun cuando los iones proceden de los átomos son, desde un punto de vista químico, muy diferentes de ellos. Así, la sustancia sodio metálico, compuesta por átomos de sodio Na, reacciona enérgicamente con el agua, mientras que el ion sodio Na+ no lo hace.
Debido a las diferencias existentes en su configuración electrónica, átomos e iones suelen presentar diferencias notables en su capacidad para reaccionar químicamente con otras sustancias.



