| Natureduca - Portal educativo de ciencia y cultura |

Química
LOS IONES
Fuerzas de enlace iónico - 1ª parte
Introducción
 a formación de cualquier compuesto a partir de los
correspondientes elementos está íntimamente relacionada con la estructura
interna de los átomos que han de enlazarse y, en particular, con la
configuración adoptada por sus electrones más externos.
a formación de cualquier compuesto a partir de los
correspondientes elementos está íntimamente relacionada con la estructura
interna de los átomos que han de enlazarse y, en particular, con la
configuración adoptada por sus electrones más externos.
En este sentido cabe hacer distinción entre los elementos metálicos y los no metálicos. Un análisis de las configuraciones electrónicas de los diferentes elementos de la tabla periódica indica que la mayor parte de los metales tienen muy pocos electrones en su última capa, mientras que en los no metales sucede todo lo contrario.
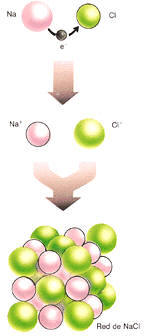
La formación de
cloruro de sodio (NaCl) es un ejemplo del resultado de las fuerzas
del enlace iónico. Estas fuerzas constituyen la red cristalina
característica de la sal común
Los metales pueden deshacerse con cierta facilidad de sus electrones más externos, dando lugar a iones de signo positivo o cationes; se dice por ello que son electropositivos; en tanto que los no metales tienden a incorporar electrones en su última capa convirtiéndose en iones de signo negativo o aniones, razón por la que son considerados como elementos electronegativos. Ambos hechos son debidos a que las configuraciones electrónicas formadas por capas completas son más estables, es decir, implican una menor energía potencial, por lo que los átomos de los diferentes elementos presentan cierta tendencia a alcanzar tal situación, que es característica de los gases nobles.
La formación del enlace iónico
Al arrancar un electrón a un átomo es un proceso que implica el consumo de una determinada cantidad de energía o energía de ionización que resulta relativamente pequeña en los metales. Tomando como referencia un metal y un no metal, como son el sodio y el cloro, se tiene:
Na + energía ionización
![]() Na+ + 1 e-
(8,2 · 10-19 J/átomo)
Na+ + 1 e-
(8,2 · 10-19 J/átomo)
Cl + energía ionización
![]() Cl+ + 1 e-
(20,8 · 10-19 J/átomo)
Cl+ + 1 e-
(20,8 · 10-19 J/átomo)
La incorporación de un electrón a un no metal típico para formar un ion negativo estable lleva consigo, por el contrario, la liberación de una cantidad de energía denominada afinidad electrónica o electroafinidad. Así:
Cl + 1 e-
![]() Cl- + afinidad
electrónica (5,8 · 10-19
J/átomo)
Cl- + afinidad
electrónica (5,8 · 10-19
J/átomo)



