| Natureduca - Portal educativo de ciencia y cultura |

Química
LAS MOLÉCULAS
Sólidos moleculares - 2ª parte
Sólidos formados por moléculas polares (continuación)
 n estado sólido las moléculas de agua se ordenan tetraédricamente,
situándose los átomos de oxígeno en los centros de los tetraedros, en tanto que
los cuatro vértices son ocupados dos por los átomos de hidrógeno propios y otros
dos por átomos de hidrógeno de otras moléculas ligados electrostáticamente al
átomo de oxígeno central. A causa de esta ordenación, cada molécula de agua
aparece rodeada únicamente por otras cuatro enlazadas entre sí por estas fuerzas
de atracción intermolecular. La estructura cristalina así formada es muy abierta
y voluminosa, es decir, poco densa.
n estado sólido las moléculas de agua se ordenan tetraédricamente,
situándose los átomos de oxígeno en los centros de los tetraedros, en tanto que
los cuatro vértices son ocupados dos por los átomos de hidrógeno propios y otros
dos por átomos de hidrógeno de otras moléculas ligados electrostáticamente al
átomo de oxígeno central. A causa de esta ordenación, cada molécula de agua
aparece rodeada únicamente por otras cuatro enlazadas entre sí por estas fuerzas
de atracción intermolecular. La estructura cristalina así formada es muy abierta
y voluminosa, es decir, poco densa.
Cuando por efecto de un aumento en la temperatura se inicia la fusión del hielo algunos enlaces entre moléculas por puentes de hidrógeno se rompen, se desmorona la estructura tetraédrica y las moléculas de agua se apiñan unas al lado de otras en un agrupamiento más compacto. Por esta razón, y en contra de lo que es habitual, el agua líquida es más densa que el hielo.
Este proceso de ruptura de enlaces de hidrógeno aumenta con la temperatura, por lo que de 0 Cº a 4 Cº el agua líquida aumenta de densidad. A partir de los 4 Cº la dilatación producida por el incremento térmico es ya capaz de contrarrestar el efecto anterior de signo opuesto, con lo que la densidad del agua comienza a disminuir con la temperatura.
El agua presenta, pues, un máximo de densidad a los 4 Cº, lo cual tiene una considerable importancia en la naturaleza al hacer posible el mantenimiento de la vida en medios subacuáticos en condiciones exteriores de bajas temperaturas.
El enlace metálico
Los elementos típicamente metálicos se caracterizan por tener pocos electrones externos, por lo general débilmente unidos al núcleo (baja energía de ionización). Esta circunstancia les permite participar en un modelo de enlace colectivo, dando lugar a cristales de un mismo elemento con propiedades que son típicas de esta forma especial de enlace entre átomos.
En un sólido metálico los electrones externos se mueven con bastante libertad, constituyendo una nube electrónica o mar de electrones deslocalizados sobre el conjunto de restos atómicos positivos. Esa especie de gas electrónico es atraído por los núcleos atómicos constituyendo el elemento de unión de todos ellos. Esta forma de enlace covalente generalizado se orienta en todas las direcciones del espacio y por ello puede dar lugar a estructuras cristalinas tridimensionales como en los sólidos iónicos.
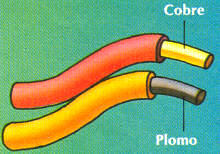
Las propiedades de los
enlaces metálicos de materiales como el cobre o el plomo permiten la
conducción de los electrones. La facilidad de desplazar los átomos en
capas les da también propiedades maleables, haciéndolos adecuados para
la fabricación de conductores eléctricos, habitualmente estirando el
material en forma de hilo.
Las características del enlace metálico explican las propiedades de los metales a nivel macroscópico. Así, la movilidad de ese mar de electrones compartidos constituye el origen de la capacidad de los metales para conducir la electricidad. Los choques de los electrones móviles con los restos metálicos de la red cristalina explican el efecto calorífico de la corriente eléctrica (efecto Joule) y la noción de resistencia eléctrica.
El hecho de que todos los átomos del cristal sean idénticos permite desplazarlos por capas, lo que explica la maleabilidad típica de los sólidos metálicos (se les puede dar forma de hojas planas) y su ductilidad (se les puede estirar formando hilos).



