| Natureduca - Portal educativo de ciencia y cultura |

Química
LAS MOLÉCULAS
Sólidos moleculares - 1ª parte
Sólidos formados por moléculas no polares
 as moléculas no polares pueden ordenarse de forma
regular, dando lugar, a temperaturas suficientemente bajas, a sólidos
cristalinos. Ello implica la existencia de ciertos tipos de fuerzas
intermoleculares que a pesar de ser muy débiles poseen un efecto ordenador que
hace posible la formación del cristal.
as moléculas no polares pueden ordenarse de forma
regular, dando lugar, a temperaturas suficientemente bajas, a sólidos
cristalinos. Ello implica la existencia de ciertos tipos de fuerzas
intermoleculares que a pesar de ser muy débiles poseen un efecto ordenador que
hace posible la formación del cristal.
El hecho de que sustancias moleculares tales como Cl2, H2, CO2, etc., sean blandas y posean muy bajos puntos de solidificación es precisamente consecuencia de la debilidad de tales fuerzas, las cuales son capaces de vencer los efectos disgregadores de la energía térmica sólo a muy bajas temperaturas. Estas fuerzas de interacción molecular reciben el nombre de fuerzas de Van der Waals.
La naturaleza de las fuerzas de Van der Waals puede explicarse del siguiente modo: aun aquellas moléculas que no poseen un carácter dipolar permanente pueden convertirse en dipolos durante brevísimos intervalos de tiempo; esto es consecuencia de los cambios que se producen en las distribuciones de carga en el interior de los átomos y que implican acumulaciones transitorias en ciertos sitios.
Las interacciones que resultan entre estos dipolos instantáneos y fluctuantes son la causa de que aparezcan estas débiles fuerzas de atracción entre moléculas no polares que dan lugar a sólidos blandos que pueden pasar a estado líquido e incluso directamente a vapor con facilidad.
Sólidos formados por moléculas polares
Las moléculas polares pueden unirse entre sí para formar estructuras cristalinas típicas del estado sólido, comportándose de una forma parecida a como lo hacen los iones en un cristal iónico. El resultado es la formación de ordenaciones reticulares o redes cristalinas cuyos puntos de fusión o de ebullición y cuya resistencia mecánica resultan superiores a las que cabría esperar si se tratase de moléculas no polares. Son las fuerzas electrostáticas por una parte y la organización reticular por otra lo que les confiere esas propiedades.
El punto de fusión o la dureza del cristal están relacionados con la solidez de la estructura y ésta a su vez con la intensidad de las fuerzas que mantienen unidos a sus componentes. El comportamiento de los sólidos de moléculas polares es, en este sentido, inferior al de los sólidos iónicos.
Un tipo de enlace intermolecular especialmente interesante se presenta cuando las moléculas en cuestión son fuertemente polares y contienen, además, algún átomo de hidrógeno. Se conoce con el nombre de enlace de hidrógeno o enlace por puentes de hidrógeno porque el átomo de hidrógeno hace de puente de unión entre las moléculas.
El agua constituye un ejemplo de sustancia en la que la presencia de puentes de hidrógeno es importante. Cada átomo de hidrógeno con su carga positiva efectiva puede atraer o ser atraído por un átomo de oxígeno de otra molécula de agua. Estas interacciones hacen que por debajo de los 0 Cº de temperatura se genere una estructura sólida cristalina: es el hielo.
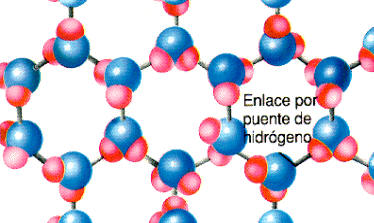
En el hielo, los enlaces
por puentes de hidrógeno son los responsables de su estructura
cristalina. Esto ocurre debido a la polaridad de la molécula de agua.



