1
2
3
Los conceptos de ácido y de base, según Arrhenius (continuación)
 l igual que para los ácidos, la fuerza de una base y su
conductividad estarían relacionadas entre sí y ambas, con el grado de
disociación que presenta dicha base en disolución acuosa.
l igual que para los ácidos, la fuerza de una base y su
conductividad estarían relacionadas entre sí y ambas, con el grado de
disociación que presenta dicha base en disolución acuosa.
Aun cuando no sean las únicas sustancias que se comportan como
bases, las combinaciones de óxidos metálicos con el agua, es decir, los
hidróxidos, son bases típicas. Las disoluciones acuosas de bases fuertes, como
el hidróxido de sodio (NaOH) o el hidróxido de potasio (KOH), son agresivas o
cáusticas con los tejidos animales blandos, como las mucosas; de ahí que el NaOH
se denomine usualmente sosa cáustica y el KOH potasa cáustica. Sus disoluciones
acuosas reciben el nombre de
lejías.Una explicación para la neutralización
La reacción mediante la cual una base neutraliza las propiedades
de un ácido recibe el nombre de
neutralización y se ajusta, en términos
generales, a una ecuación química del tipo:
ácido + base
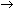 sal + agua
sal + agua
Así, por ejemplo:
HCI(aq) + NaOH(s)
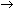 NaCl(aq) + H2O
NaCl(aq) + H2O
De acuerdo con la teoría de Arrhenius, la neutralización se
reduce a una reacción entre los iones H
+ y OH
- característicos respectivamente
de ácidos y bases para dar agua:
H+
+ OH-
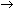 H2O
H2O
Si la concentración de base es suficiente, todos los iones H
+
procedentes del ácido serán neutralizados por los OH
- procedentes de la base. Un
exceso de base otorgará a la disolución resultante un carácter básico.
Por el
contrario, la existencia de iones H+ no neutralizados, debido a un exceso de
ácido, dará lugar a que la disolución tenga carácter ácido.
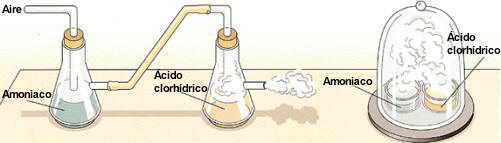
La reacción del ácido clorhídrico
(HCl) con el amoniaco (NH3)
es una reacción de neutralización que da lugar a la producción de sales de
amonio.
Aun cuando la teoría de Arrhenius tiene esa validez restringida
característica de las primeras aproximaciones, constituyó, sin embargo, un
adelanto importante en la explicación de los procesos químicos, y a pesar de sus
limitaciones, se sigue aún utilizando por su sencillez en aquellas
circunstancias en las que la facilidad de comprensión pesa más que el estricto
rigor científico.
1
2
3

 l igual que para los ácidos, la fuerza de una base y su
conductividad estarían relacionadas entre sí y ambas, con el grado de
disociación que presenta dicha base en disolución acuosa.
l igual que para los ácidos, la fuerza de una base y su
conductividad estarían relacionadas entre sí y ambas, con el grado de
disociación que presenta dicha base en disolución acuosa.![]() sal + agua
sal + agua![]() NaCl(aq) + H2O
NaCl(aq) + H2O![]() H2O
H2O



