| Natureduca - Portal educativo de ciencia y cultura |

Química
VELOCIDAD Y EQUILIBRIO EN QUÍMICA
Factores que modifican la velocidad de reacción - 1ª parte
Introducción
 n modo de explicar el mecanismo mediante
el cual las reacciones químicas se llevan a efecto es admitiendo que tales
procesos son el resultado del choque entre las moléculas de las sustancias
reaccionantes. Sólo cuando dicho choque es suficientemente violento se romperán
las moléculas y se producirá la reordenación entre los átomos resultantes.
n modo de explicar el mecanismo mediante
el cual las reacciones químicas se llevan a efecto es admitiendo que tales
procesos son el resultado del choque entre las moléculas de las sustancias
reaccionantes. Sólo cuando dicho choque es suficientemente violento se romperán
las moléculas y se producirá la reordenación entre los átomos resultantes.
El desarrollo riguroso de estas ideas básicas constituye la llamada teoría de colisiones. Nos apoyaremos, en lo que sigue, en esta interpretación de las reacciones químicas para describir cómo intervienen diferentes factores en la modificación de la velocidad de reacción.
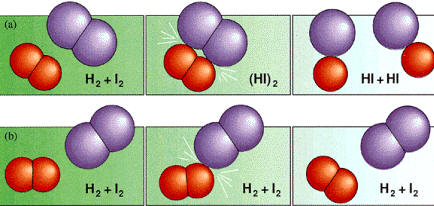
Según la teoría de las
colisiones, las reacciones químicas se producen como consecuencia de choques
efectivos de las moléculas de los reactivos con la aparición de nuevas
moléculas.
Efecto de la concentración
Por la misma razón que son más frecuentes los accidentes de tráfico en las, «horas punta», cuanto mayor sea el número de moléculas de los reactivos presentes en un mismo volumen más fácilmente podrán colisionar.Asimismo, cuanto mayor sea el número de colisiones que se producen en la unidad de tiempo, tanto más probable será la realización de un choque eficaz, esto es, de un choque que dé lugar a la transformación de las moléculas.
De esta forma se explica el hecho experimentalmente observado, de que al aumentar la concentración de los reactivos aumente la velocidad de la reacción química.
La concentración de los
reactivos influye en la velocidad de una reacción química. Cuanto mayor
sea esta concentración mayor será el número de colisiones que se
producen por segundo, y tanto más probable será la realización de un
choque eficaz.
Efecto de la temperatura
De acuerdo con la teoría cinético-molecular de la materia, las moléculas constituyentes de cualquier tipo de sustancia se hallan en continua agitación vibrando o desplazándose con una energía cinética que es directamente proporcional a la temperatura absoluta T a la que se encuentre dicha sustancia. Experimentalmente se observa que la velocidad de una reacción aumenta bastante rápidamente con la temperatura.Considerando conjuntamente la teoría cinética y la teoría de colisiones es posible explicar tal comportamiento. Al aumentar la temperatura, la energía cinética de las moléculas de los reactivos aumenta, con lo que los choques son más violentos poniéndose en juego en un mayor número de ellos la energía suficiente como para superar esa barrera que constituye la energía de activación.
El efecto conjunto de estos procesos individuales se traduce en que una mayor cantidad de reactivos se transforma en la unidad de tiempo, es decir, la velocidad de reacción aumenta notablemente.



