| Natureduca - Portal educativo de ciencia y cultura |

Química
LAS MOLÉCULAS
La masa de las moléculas y compuestos - 2ª parte
La masa de una molécula y de un mol
 as masas moleculares se expresan en unidades de masa atómica (u), las
cuales, por su tamaño, resultan apropiadas a este tipo de cantidades. La masa de
una molécula en u será la suma de las masas de los diferentes átomos que la
componen y que aparecen recogidos en la fórmula molecular correspondiente.
as masas moleculares se expresan en unidades de masa atómica (u), las
cuales, por su tamaño, resultan apropiadas a este tipo de cantidades. La masa de
una molécula en u será la suma de las masas de los diferentes átomos que la
componen y que aparecen recogidos en la fórmula molecular correspondiente.
Así la masa molecular del metano (CH4) será 4M(H) + 1M(C), siendo M(H) y M(C) las masas atómicas de los átomos de hidrógeno y carbono respectivamente; es decir, M(CH4) = 4 · 1,008 + 12,011 = 16,043 u.
Como cantidad de sustancia, un mol de un compuesto dado es igual a un mol de sus moléculas, lo que equivale, de acuerdo con la definición de mol, a NA moléculas, siendo NA = 6,023 · 1023 el número de Avogadro. Dado que 1 gramo equivale a NA u, el mismo número que indica la masa de una molécula en unidades de masa atómica indica también el valor de su mol expresado en gramos. Así un mol de metano equivale a
NA · 16,043 u = 16,043 NA u = 16,043 g
A la masa expresada en gramos que corresponde a un mol de una sustancia compuesta se la denomina también molécula-gramo.
Aplicación del concepto de mol
El cloroformo es una sustancia que se emplea como anestésico y cuya fórmula química es:
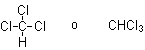
Calcular su masa molecular en u y el valor de su mol en gramos. ¿Cuántos moles de sustancia estarán contenidos en una muestra de 15,00 gramos? ¿Y cuántas moléculas? ¿Y cuántos átomos de cloro? Determinar el porcentaje en masa de cloro que contiene el cloroformo.
La masa molecular M es la suma de las masas atómicas, de modo que:
M(CHCl3) = M(C) + M(H) + 3M(CI) = 12 + 1 + 3 · 35,5 = 119,5 u
y por tanto,
1 mol de CHCI3 = 119,5 gramos
El número de moles de CHCl3 contenidos en 15,00 g de sustancia se obtendrá dividiendo la masa en gramos por el número de gramos por mol:
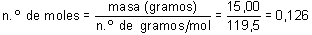
Dado que cada mol de CHCl3 equivale a NA moléculas, resultará:
n. de moléculas = n. moles · NA = 0,126 · 6,023 · 1023 = 0,759 · 1023
Por cada molécula de CHCl3 hay tres átomos de cloro, de modo que en esta sustancia se cumplirá:
n. de átomos (CI) = n. moléculas (CHCl3) · 3 = 0,759 · 1023 · 3 = 2,277 · 1023
Finalmente el tanto por ciento en masa de cloro se calculará a partir de la contribución del cloro a la masa molecular. De las 119,5 u del CHCl33 · 35,5 = 106,5 proceden del cloro, por tanto: