| Natureduca - Portal educativo de ciencia y cultura |

Química
LAS MOLÉCULAS
Formación de las moléculas - 1ª parte
Introducción
 nte la diversidad de elementos químicos existentes en
la naturaleza cabe preguntarse cuál es la razón por la que unos átomos se reúnen
formando una molécula y otros no; o de otra manera, por qué no toda molécula o
agrupación de átomos imaginable tiene existencia real.
nte la diversidad de elementos químicos existentes en
la naturaleza cabe preguntarse cuál es la razón por la que unos átomos se reúnen
formando una molécula y otros no; o de otra manera, por qué no toda molécula o
agrupación de átomos imaginable tiene existencia real.
Una primera respuesta puede hallarse en la tendencia observada en todo sistema físico a alcanzar una condición de mínima energía. Aquella agrupación de átomos que consiga reducir la energía del conjunto dará lugar a una molécula, definiendo una forma de enlace químico que recibe el nombre de enlace covalente.
Junto con esa idea general de configuración de energía mínima, otros intentos de explicación de este tipo de enlace entre átomos han sido planteados recurriendo a las características fisicoquímicas de las estructuras electrónicas de los átomos componentes.
La teoría de Lewis
El químico estadounidense G. B. Lewis (1875-1946) advirtió que el enlace químico entre átomos no podía explicarse como debido a un intercambio de electrones. Dos átomos iguales intercambiando electrones no alterarían sus configuraciones electrónicas; las ideas válidas para el enlace iónico no eran útiles para explicar de una forma general el enlace entre átomos. Sugirió entonces que este tipo de enlace químico se formaba por la comparación de uno o más pares de electrones o pares de enlace.
Por este procedimiento los átomos enlazados alcanzaban la configuración electrónica de los gases nobles. Este tipo de configuración de capas completas se corresponde con las condiciones de mínima energía o máxima estabilidad características de la situación de enlace.
La teoría de Lewis, conocida también como teoría del octete por ser éste el número de electrones externos característicos de los gases nobles, puede explicar, por ejemplo, la formación de la molécula de yodo I2:
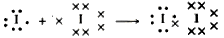
Ambos átomos, que individualmente considerados tienen siete electrones en su
capa externa, al formar la molécula de yodo pasan a tener ocho mediante la
comparación del par de enlace
 .
.
Existen moléculas cuya formación exige la comparación de más de un par de electrones. En tal caso se forma un enlace covalente múltiple. Tal es el caso de la molécula de oxígeno O2:
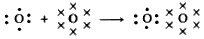
para cuya formación se comparten dos pares de electrones. Representado cada par de electrones mediante una línea resulta:
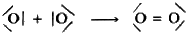
que indica más claramente la formación de un doble enlace.
En la molécula de nitrógeno N2 sucede algo semejante, sólo que en este caso se han de compartir tres pares de electrones para alcanzar el octete, con la formación consiguiente de un triple enlace:
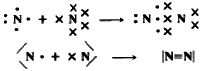
Esta explicación puede extenderse al caso de las moléculas formadas por átomos de elementos no metálicos diferentes entre sí, tales como HCl, NH3, H2O o CO2 por ejemplo:

La teoría de Lewis
dice que la configuración estable se consigue con ocho electrones
externos. Para ello el nitrógeno debe unirse a tres hidrógenos
obteniendo un octete.



