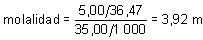| Natureduca - Portal educativo de ciencia y cultura |

Química
LAS DISOLUCIONES
La composición de las disoluciones - 2ª parte
Formas de expresar la concentración (continuación)
Tanto por ciento en peso
 xpresa la masa en gramos de soluto disuelta por cada cien gramos de
disolución. Su cálculo requiere considerar separadamente la masa del soluto y la
del disolvente:
xpresa la masa en gramos de soluto disuelta por cada cien gramos de
disolución. Su cálculo requiere considerar separadamente la masa del soluto y la
del disolvente:
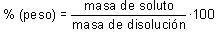
siendo la masa de la disolución la suma de la del soluto y la del disolvente.
Para el estudio de ciertos fenómenos físico-químicos resulta de interés expresar la concentración en términos de proporción de cantidad de soluto a cantidad de disolvente. Se emplea entonces la molalidad:
Molalidad
Indica el número de moles de soluto disuelto en cada kilogramo de disolvente:
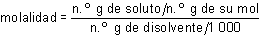
Como en el caso de la molaridad, la concentración molal de una disolución puede expresarse en la forma 2 m (dos molal) o 0,1 m (0,1 molal), por ejemplo.
Aplicación del cálculo de concentraciones
Se mezclan 5,00 g de cloruro de hidrógeno (HCI) con 35,00 g de agua, formándose una disolución cuya densidad a 20 Cº es de 1,060 g/cm3.
Calcúlese: a) El tanto por ciento en peso. b) La concentración en gramos por litro. c) La molaridad y d) La molalidad.
a) Tanto por ciento.
Se trata de calcular el número de gramos de soluto por cada cien gramos de disolución, es decir:
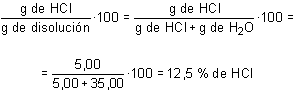
b) Gramos/litro.
Puesto que los datos están referidos a masas y no a volúmenes, es necesario recurrir al valor de la densidad y proceder del siguiente modo:
1. Se calcula la masa de un litro de disolución:
masa = volumen · densidad = 1 000 cm3 · 1,060 g/cm3 = 1 060 g
2. A partir del valor del tanto por ciento en peso se determina la masa en gramos del soluto contenida en la disolución:
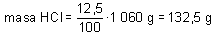
La cantidad resultante representa la concentración en gramos de soluto (HCI) por litro de disolución.
c) Molaridad.
Dado que:

Sustituyendo resulta:
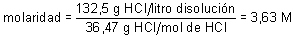
donde 36,47 es la masa molecular del HCI y, por tanto, la masa de su mol expresada en gramos.
De lo anterior se deduce que, cuando los datos del volumen de la disolución no son explícitos, el cálculo de la molaridad implica las etapas a y b como pasos intermedios.
d) Molalidad.
De acuerdo con su definición:
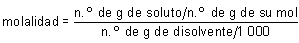
sustituyendo se tiene: