| Natureduca - Portal educativo de ciencia y cultura |

Química
ENERGÍA Y REACCIÓN QUÍMICA
Energía y procesos químicos - 1ª parte
Conceptos fundamentales
 oda reacción química lleva asociada una variación
observable de energía que puede manifestarse en forma luminosa, eléctrica,
mecánica o calorífica, siendo esta última, con mucho, la más frecuente.
oda reacción química lleva asociada una variación
observable de energía que puede manifestarse en forma luminosa, eléctrica,
mecánica o calorífica, siendo esta última, con mucho, la más frecuente.
Para estudiar un proceso químico desde un punto de vista energético, se suele considerar separadamente el conjunto de sustancias en transformación, denominado genéricamente sistema, del resto, que recibe el nombre de medio o entorno.
De acuerdo con lo anterior, las reacciones químicas implican una transferencia de energía que en unas ocasiones se lleva a cabo del sistema al medio y en otras en sentido inverso. Si la reacción lleva consigo un desprendimiento de calor del sistema al medio, se denomina exotérmica. Por el contrario, si el proceso químico implica la absorción de una cierta cantidad de calor del medio por parte del sistema, se denomina endotérmica.
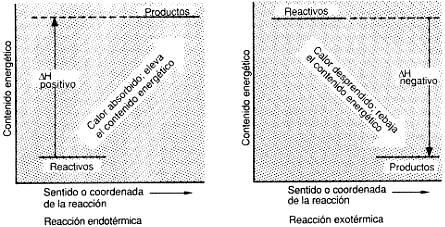
En las reacciones endotérmicas
se absorbe energía mientras que en las exotérmicas el proceso libera
energía.
Todas las reacciones de combustión son exotérmicas; así, la reacción de combustión del hidrógeno libera gran cantidad de calor:
H2 + 1/2 O2
![]() H2O + calor
H2O + calor
Por el contrario, la reacción de descomposición del carbonato de calcio es endotérmica pues requiere la aportación al sistema de una cierta cantidad de energía calorífica del medio:
CaCO3 + calor
![]() CO2
+ CaO
CO2
+ CaO
La cantidad de calor desprendido o absorbido en una reacción química, referida a las cantidades de sustancias, en número de moles, que figuran en la correspondiente ecuación química ajustada, se denomina calor de reacción. Se expresa en kilocalorías (kcal) o en kilojulios (kJ) y suele situarse en el segundo miembro de la ecuación; en el caso de que se trate de una reacción endotérmica irá precedido de un signo menos.
Los calores de reacción dependen de las condiciones de presión, temperatura y estado físico (sólido, líquido o gaseoso) del sistema; por ello, cuando se pretendan hacer cálculos de energía deben especificarse en la ecuación química dichas condiciones.



