| Natureduca - Portal educativo de ciencia y cultura |

Física
ONDAS Y PARTÍCULAS
El principio de indeterminación - 3ª parte
La relación de indeterminación energía-tiempo
 l principio de indeterminación de Heisenberg puede aplicarse
también al par de variables energía-tiempo en la forma:
l principio de indeterminación de Heisenberg puede aplicarse
también al par de variables energía-tiempo en la forma:
![]()
Una deducción simplificada de esta nueva relación de indeterminación puede hacerse para los procesos de emisión de radiación por un átomo en la forma siguiente. De acuerdo con la ecuación de Planck E = hf y dado que h es una constante, se podrá expresar en términos de imprevisiones en la forma ∆E = h∆f. Pero f = 1/T y T es el período de la onda electromagnética correspondiente, se trata por tanto de un tiempo, por lo que ∆f = 1/∆t, es decir, ∆E · ∆t = h.
Una de las consecuencias de esta relación la constituye la anchura de líneas de los espectros de emisión o de absorción de radiación por los átomos. Cuando un átomo recibe energía de ciertas características, se excita desprendiendo a continuación ese exceso de energía en forma de radiación. El tiempo que transcurre entre la excitación y la emisión es del orden de ∆t = 10 8 s lo cual, aplicando la relación: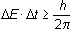
Aplicación de la relación de incertidumbre
Comparar, de acuerdo con el principio de Heisenberg, las indeterminaciones en las velocidades de un electrón y de un protón en el supuesto de que estuvieran ambos confinados en una caja cuya dimensión máxima fuera de 10 Å.(Tómense las masas del protón y del electrón como mp = 1,672 · 10-27 kg; me = 9,108 · 10-31 kg y la constante de Planck h = 6,625 · 10-34 J · s.)
La relación de indeterminación posición-cantidad de movimiento puede escribirse en la forma:
![]()
p = mv se puede escribir como:
∆p = m · ∆v
Sustituyendo en la relación de indeterminación, resulta:
![]()
![]()
![]()



