| Natureduca - Portal educativo de ciencia y cultura |

Física
LA ESTÁTICA DE FLUIDOS
La estática de los gases - 1ª parte
La aerostática frente a la hidrostática
 esde un punto de vista mecánico, la
diferencia fundamental entre líquidos y gases consiste en que estos últimos
pueden ser comprimidos. Su volumen, por tanto, no es constante y
consiguientemente tampoco lo es su densidad. Teniendo en cuenta el papel
fundamental de esta magnitud física en la estática de fluidos, se comprende que
el equilibrio de los gases haya de considerarse separadamente del de los
líquidos.
esde un punto de vista mecánico, la
diferencia fundamental entre líquidos y gases consiste en que estos últimos
pueden ser comprimidos. Su volumen, por tanto, no es constante y
consiguientemente tampoco lo es su densidad. Teniendo en cuenta el papel
fundamental de esta magnitud física en la estática de fluidos, se comprende que
el equilibrio de los gases haya de considerarse separadamente del de los
líquidos.

La aerostática se encarga
del estudio de los gases ya que su comportamiento es diferente al de los
líquidos. El principio de Arquímedes sigue siendo válido y es el
fundamento de la elevación de los globos.
Así, la ecuación fundamental de la hidrostática no puede ser aplicada a la aerostática. El principio de Pascal, en el caso de los gases, no permite la construcción de prensas hidráulicas.
El principio de Arquímedes conserva su validez para los gases y es el responsable del empuje aerostático, fundamento de la elevación de los globos y aeróstatos. Sin embargo, y debido a la menor densidad de los gases, en iguales condiciones de volumen del cuerpo sumergido, el empuje aerostático es considerablemente menor que el hidrostático.
La compresibilidad de los gases: Ley de Boyle
El volumen del gas contenido en un recipiente se reduce si se aumenta la presión. Esta propiedad que presentan los gases de poder ser comprimidos se conoce como compresibilidad y fue estudiada por el físico inglés Robert Boyle (1627-1691).Si se dispone de un cilindro con un émbolo móvil que puede modificar el volumen de aquél y se introduce un gas en su interior, el volumen ocupado por el gas variará con la presión del émbolo de tal modo que su producto se mantiene constante si la temperatura es constante durante el experimento. Es decir:
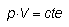
(5.9)
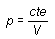
Este resultado se conoce como ley de Boyle y describe de forma aproximada el comportamiento de un gas en un amplio rango de presiones y volúmenes. No obstante, a temperaturas elevadas o a presiones elevadas, para las cuales el gas se aproxima bastante al estado líquido, la ley de Boyle deja de cumplirse con una precisión razonable.
La presión atmosférica

La atmósfera está
formada por una capa de gases que envuelve nuestro planeta y ejerce
sobre nosotros lo que llamamos la presión atmosférica. El valor de
esta presión varía con la altitud.
Del mismo modo que existe una presión hidrostática en los líquidos asociada al peso de unas capas de líquido sobre otras, las grandes masas gaseosas pueden dar lugar a presiones considerables debidas a su propio peso. Tal es el caso de la atmósfera. La presión del aire sobre los objetos contenidos en su seno se denomina presión atmosférica.



