| Natureduca - Portal educativo de ciencia y cultura |

Física
CALOR Y ENERGÍA TÉRMICA
Cantidades de calor - 2ª parte
Calor específico y capacidad calorífica
 a ecuación calorimétrica puede escribirse también en la forma:
a ecuación calorimétrica puede escribirse también en la forma:
Q = C(Tf - Ti)
(8.7)
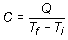
A diferencia del calor específico, la capacidad calorífica es una característica de cada cuerpo y se expresa en el SI en J/K. Su relación con el calor específico resulta de comparar las ecuaciones (8.6) y (8.7) en las que ambas magnitudes están presentes:
C = m · c
(8.8)
Aplicación de la determinación del calor específico
El calor específico de un cuerpo puede determinarse mediante el calorímetro. Dado que éste es un atributo físico característico de cada sustancia, la comparación del valor obtenido con los de una tabla estándar de calores específicos puede ayudar a la identificación de la sustancia que compone el cuerpo en cuestión.Se pretende identificar el metal del que está formada una medalla. Para ello se determina su masa mediante una balanza que arroja el valor de 25 g. A continuación se calienta al «baño María», hasta alcanzar una temperatura de 85 ºC y se introduce en el interior de un calorímetro que contiene 50 g de agua a 16,5 ºC de temperatura. Al cabo de un cierto tiempo y tras utilizar varias veces el agitador, la columna del termómetro del calorímetro deja de subir señalando una temperatura de equilibrio de 19,5 ºC. ¿De qué metal puede tratarse?
Si se aplica la ecuación de conservación de la energía expresada en la forma, calor tomado = - calor cedido, resulta:Q1 = - Q2
m1c1(T - T1) = - m2c2(T - T2)
considerando en este caso el subíndice 1 referido al agua y el 2 referido a la moneda. Sustituyendo valores en la ecuación anterior, se tiene:50 · 1 (19,5 - 16,5) = - 25 · c2 (19,5 - 85)
Operando y despejando c2 resulta:150 = 1 637,5 · c2
c2 = 0,09 cal/g · ºC
Si se compara el resultado con una tabla de calores específicos de metales, se concluye que puede tratarse de cobre. Otras propiedades físicas como el color, por ejemplo, confirmarán el resultado.



