| Natureduca - Portal educativo de ciencia y cultura |

Química
ELEMENTOS QUÍMICOS Y SISTEMA PERIÓDICO
Los elementos químicos y su clasificación - 3ª parte
El sistema periódico
 a versión actual de la tabla periódica, también llamada sistema periódico de
los elementos, difiere en algunos detalles de la original de Mendeleiev. Así el
criterio de ordenación es el número atómico del elemento y no su masa atómica,
lo que en ocasiones da lugar a inversiones respecto del orden previsto por Mendeleiev; tal es el caso, entre otras, de las parejas argón-potasio y
cobalto-níquel.
a versión actual de la tabla periódica, también llamada sistema periódico de
los elementos, difiere en algunos detalles de la original de Mendeleiev. Así el
criterio de ordenación es el número atómico del elemento y no su masa atómica,
lo que en ocasiones da lugar a inversiones respecto del orden previsto por Mendeleiev; tal es el caso, entre otras, de las parejas argón-potasio y
cobalto-níquel.
Los elementos con números atómicos 58 al 71 y 90 al 103, denominados lantánidos y actínidos respectivamente y conocidos genéricamente como tierras raras, alteran el carácter compacto de la tabla y por ello se sitúan en su parte inferior. La ley periódica defendida por Mendeleiev como eje de su tabla no tiene un carácter exacto, aunque sí muy aproximado.
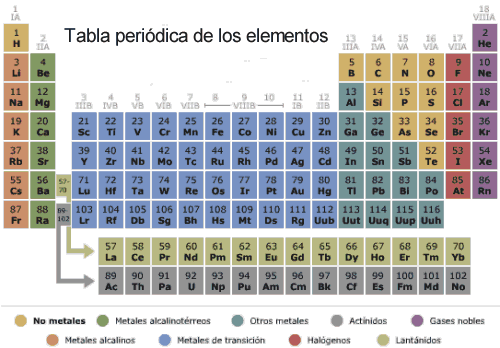
Ilustración MS Encarta
En cuanto a su ordenación, los elementos se agrupan dentro del sistema periódico en siete series horizontales, que son los periodos de esta nueva tabla, y dieciocho series verticales llamadas grupos. Los grupos constituyen familias de elementos con propiedades semejantes que varían de una forma gradual al desplazarse de arriba a abajo por una serie dada. Tanto los periodos como los grupos incluyen un número de elementos que no es el mismo para cada uno de ellos, por lo que la tabla en su conjunto no es rectangular.
El grupo IA está formado por el hidrógeno y la familia de los elementos alcalinos: litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). El grupo IIA lo constituyen los elementos alcalinotérreos: berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra). Los elementos térreos forman el grupo IIIA: boro (B), aluminio (Al), galio (Ga), indio (In) y talio (TI). El grupo IVA se denomina grupo del carbono-silicio o de los elementos carbonoideos: carbono (C), silicio (Si), germanio (Ge), estaño (Sn) y plomo (Pb). Análogamente el VA constituye el grupo del nitrógeno-fósforo o de los elementos nitrogenoideos: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb) y bismuto (Bi). El grupo VIA es el de los elementos calcógenos, que en griego significa formadores de minerales: oxígeno (0), azufre (S), selenio (Se), teluro (Te) y polonio (Po). Finalmente el grupo VIIA está constituido por los llamados gases nobles: helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn). Todos los elementos comprendidos en los grupos A se denominan genéricamente elementos representativos.
El resto de los elementos situados en los grupos B reciben el nombre de elementos de transición. Los veintiocho elementos que en dos filas de catorce se hallan situados en la parte baja de la tabla, como apartados del sistema principal, constituyen los llamados elementos de transición interna. Los elementos de la primera de estas filas son los lantánidos y habría que situarlos, como indica el asterisco en la tabla periódica adjunta, entre el lantano La(57) y el hafnio Hf(72). Análogamente los de la segunda fila se situarían entre el actinio Ac(89) y el 104. Son los actínidos.
La línea quebrada imaginaria que en forma de escalera limita los elementos 5, 14, 33, 52 y 85, divide el sistema periódico en dos conjuntos de elementos de propiedades químicas bien diferenciadas. Los que quedan a su izquierda se denominan metales, los que quedan a su derecha son los no metales. Los elementos situados en las proximidades de la frontera presentan propiedades no muy bien definidas, pudiendo actuar como metales o como no metales indistintamente.



